2. 广西大学 清洁化制浆造纸与污染控制重点实验室,广西 南宁 530004
2. Key Laboratory of Clean Pulp & Papermaking and Pollution Control, Guangxi University, Nanning 530004, Guangxi, China
桃树属蔷薇科落叶乔木,我国主要栽培果树品种之一。桃子具有丰富的营养价值,桃仁还具有活血祛瘀、止咳平喘、润肠通便之功效。初春的桃花除了给人们带来美的享受外,更具有“杀疰恶鬼,令人好颜色”、“除水肿……利大小便”等作用[1]。从桃花中提取的精油具有保健美容的作用,可以作为食品添加剂及化妆品、优质香皂等的重要原料[2~4]。目前,有关桃花精油提取的报道较少。本论文研究了乙醇提取桃花精油的方法,以期对桃花的综合利用提供参考[5]。
目前,提取精油的主要方法有蒸馏萃取法、溶剂浸提法、吸附法、超临界CO2萃取法等[6]。植物精油的提取,传统上使用水蒸气蒸馏法,但其抽取率较低,且加热会破坏植物细胞的热敏感成份,影响产品品质。超临界CO2萃取法对于设备的要求比较高,耗资高,不适用于大型产业化生产。近年来,植物精油提取技术快速发展,出现了一些新的植物精油提取方法,例如,亚临界流体萃取法、微胶囊-双水相萃取法、分子蒸馏、生物酶制剂辅助提取、超声波辅助萃取等方法[7, 8],这些方法在现有技术的基础上又辅以新技术、新设备,是未来精油提取的主要研究方向,但在现阶段设备成本较高,经济效益不如传统的溶剂抽提法。
本文用乙醇对桃花精油进行抽提,相较于传统的压榨法、蒸馏法,用乙醇抽提桃花精油,更加便利,桃花精油组分的保留更完整,得到的有效成分更全面,而且乙醇对人体健康的影响较小,易分离。本文采用正交法实验得到了乙醇提取桃花精油的较优条件,并对其多酚和黄酮含量进行了测定,最后采用气相色谱质谱(GC-MS)对其主要成分进行分析。
1 材料与方法 1.1 实验原料、试剂及设备① 干桃花,山东市临沂市沂水县诸葛镇;无水乙醇(分析纯)、芦丁,国药集团化学试剂有限公司;没食子酸(分析纯),天津市科密欧化学试剂有限公司;福林酚显色剂,上海蓝季科技发展有限公司;碳酸钠(分析纯),天津市北联精细化工化学品开发有限公司;亚硝酸钠(分析纯),天津巴斯夫化工有限公司;硝酸铝(分析纯)、氢氧化钠(分析纯),天津市恒兴化学试剂制造有限公司;蒸馏水,自制。
② 气相色谱质谱联用仪(QP2010UItra),岛津公司;紫外可见光分光光度计(TU-1810),北京普析通用仪器有限责任公司;超声波清洗机(M2000),苏州创意电子有限公司。
1.2 桃花精油的抽提① 对桃花花瓣进行筛选,用粉碎机对桃花进行粉碎,得到小颗粒桃花粉末,待用。
② 精确称取1 g已经粉碎的桃花粉末,用预先经乙醇抽提1~2 h的定性滤纸包扎,用线扎住,放进索氏抽提器中,加入不少于150 mL乙醇使超过其溢流水平,并多加20 mL左右。装上冷凝器,连接抽提仪器,置于水浴中。调节加热器使乙醇沸腾速率为每小时在索氏抽提器中的循环不少于4次。如此抽提6 h,抽提完毕后,用夹子小心地从抽提器中取出盛有试样的纸包,然后将冷凝器重新与抽提器相连,蒸发至抽提底瓶液约为30 mL为止,回收一部分乙醇。
③ 取下底瓶,将瓶内液体冷却至室温,装瓶存放,待测。
1.3 精油有效含量的测定 1.3.1 多酚含量的测定取没食子酸25 mg,用水溶解定容至250 mL。精密吸取对照品溶液0.0,0.1,0.2,0.3,0.4,0.5 mL于25 mL比色瓶中,再加入1 mL福林酚显色剂,摇匀后加入2 mL 10%Na2CO3溶液加水定容至10 mL。室温下反应20 min于760 nm处测定吸光值。
取0.1 mL样品于比色管中,再加入1 mL福林酚显色剂,方法同上,于760 nm处测定吸光值。以空白实验做对照组。
1.3.2 黄酮含量的测定取芦丁标准品10 mg,加入几滴无水乙醇,用60%乙醇定容至100 mL,得对照品标准溶液。取芦丁标准液0.00,0.20,0.40,0.60,0.80和1.00 mL分别加入1~6号比色管中。再向其中加入5 mL蒸馏水,加入0.2 mL 5%NaNO2,摇匀,静止6 min。分别加入0.2 mL 10%Al(NO3)3,摇匀后静置6 min。分别加入1 mL 4%NaOH,用60%乙醇定容至10 mL。摇匀,静置15 min后于510 nm处测吸光度。
取试样0.1 mL,再向其中加入5 mL蒸馏水,加入0.2 mL 5%NaNO2,摇匀,静止6 min。分别加入0.2 mL 10%Al(NO3)3,摇匀后静置6 min。分别加入1 mL 4%NaOH,用60%乙醇定容至10 mL。摇匀,静置15 min后于510 nm处测吸光度。以空白实验作为对照组。
1.3.3 桃花精油的气质分析色谱条件:色谱柱:Rxi-5sil MS 30 m ×0.25 mm ×0.25 μm;柱温:70℃,保持5 min,然后以5℃/min的速度升至200℃,保持10 min;汽化室温度:230 ℃;载气:He;载气压力:100 kPa;离子源:EI源,离子源温度:220 ℃,进行气质分析。
2 结果与分析 2.1 桃花精油测定正交试验桃花精油抽提最优条件的获得是通过三因素三水平正交试验得到的,表 1、2是桃花精油抽提正交试验的结果。研究单因素溶剂用量,抽提时间,桃花形态对乙醇抽提桃花精油中多酚与黄酮含量的影响,每个因素三个水平,用L9(34)的正交表进行试验,确定三个因素的水平组合,即最优组合。
|
|
表 1 桃花精油多酚含量正交试验结果及分析 Table 1 Results and analysis from orthogonal test for content of polyphenols in peach blossom essential oil |
|
|
表 2 桃花精油黄酮含量正交试验结果及分析 Table 2 Results and analysis from orthogonal test for content of flavone in peach blossom essential oil |
从以上两个L9(34)正交表中可以看出,乙醇抽提中各项因素对多酚和黄酮的含量的影响中,最主要的因素是抽提时间,其次是溶剂用量,最后是桃花形态,并得到乙醇抽提桃花精油的较优条件:抽提时间6 h,溶剂容量为1 g桃花用150 mL乙醇,桃花形态为粉末。在此条件下,做了多次重复验证实验,此时多酚含量为0.067%,黄酮含量为0.24%。此时桃花精油的总得率为31.45%,高于耿明江等[2]用水蒸气法对桃花精油的抽提的得率8.47%,说明乙醇相较于水蒸气对桃花精油的抽提得率较高。
2.2 桃花精油的气相色谱质谱联用仪分析在条件为:抽提时间6 h,料液比为1 g:150 mL,桃花形态为桃花粉末时所得到的桃花精油进行GC-MS分析,得以下结果,见图 1。
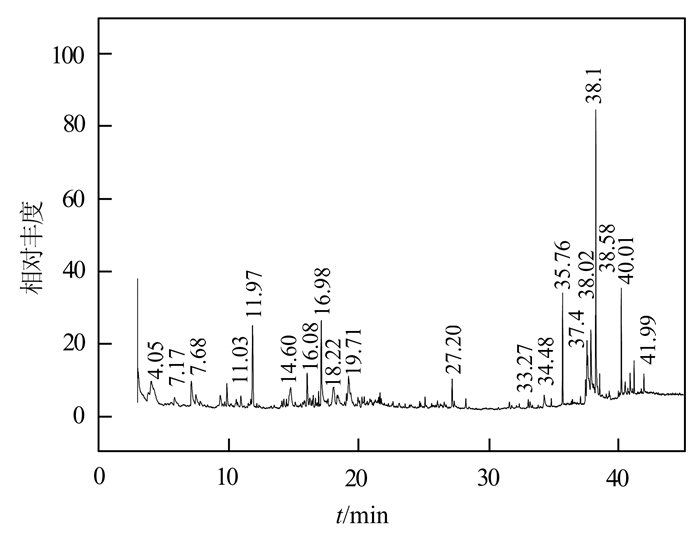
|
图 1 桃花精油的气相色谱质谱分析谱图 Figure 1 Gas chromatography-mass spectrometry chart of peach blossom essential oil |
从图 1和表 3可以看出,乙醇提取的桃花精油含有少量的酚、酮和多糖,分别为2-甲氧基-4-乙烯基苯酚、2, 4-二(1, 1-二甲基乙基)-苯酚、2, 3-二氢-3, 5-二羟基-6-甲基-4-吡喃-4-酮、5-十三烷酮、β-D-吡喃葡萄糖苷和苄基-β-D-葡萄糖苷。还含有一部分的油以及大量的酰胺、酸和腈类化合物。其中,酮、酚类,醇类,脂肪酸及其酯类含量的多少是决定其香气品质的主要成分[9, 10],并且桃花多糖和桃花多酚对羟基自由基和超氧阴离子有较强的清除作用[4, 11],黄酮类化合物具有抗菌、抗光敏、解毒、增白等作用[12]有助于人体的保健,在化妆品和保健养生领域有广阔的发展前景。
|
|
表 3 桃花精油的主要成分分析 Table 3 Analysis of the main components of peach blossom essential oil |
本文通过正交试验的方法得到了乙醇抽提桃花精油的较优工艺条件,并对其多酚和黄酮含量进行测定。对乙醇提取桃花精油影响最大的因素是抽提时间,其次是料液比,影响最小的是桃花形态。乙醇抽提桃花精油的较优工艺条件是抽提时间为6 h,料液比为1 g:150 mL,桃花形态为粉末。此时,黄酮含量为0.24%,多酚含量为0.067%。最后对制得的桃花精油进行GC-MS分析,得到桃花精油的主要成分,含有少量的酚、酮和多糖,以及大量的酯、酸、酰胺和腈类化合物。
| [1] |
Li S Z. Compendium of materia medica[M]. Hefei: Anhui science and Technology Press, 2001, 1 016-1 019. 李时珍. 本草纲目[M]. 合肥: 安徽科技出版社, 2001, 1 016-1 019. |
| [2] |
Liu Q, Teng W, Su B Y, et al. Analysis of nutrition elements in peach blossom and its potential application[J]. Amino Acids Biotic Resour, 1996, 18(4): 31-33. 柳琪, 滕薇, 苏本玉, 等. 桃花营养元素的分析与开发[J]. 氨基酸和生物资源, 1996, 18(4): 31-33. |
| [3] |
Kim Y H, Yang H E, Park B K, et al. The extract of the flowers of Prunus persica, a new cosmetic ingredient, protects against solar ultraviolet-induced skin damage in vivo[J]. J Cosmet Sci, 2002, 53(1): 27-34. |
| [4] |
Guo C Z, Shao F J, Yan G Q. Extraction of polysaccharide from peach flower and its antioxidant activity[J]. Chin Tradit Herbal Drug, 2009, 40(S1): 156-158. 郭彩珍, 邵芬娟, 闫桂琴. 桃花多糖的提取及其抗氧化活性研究[J]. 中草药, 2009, 40(S1): 156-158. |
| [5] |
Geng M J, Liu Z L, Xi R Y, et al. Optimize the extraction technology of essential oil from peach blossom by orthogonal design[J]. Journal of Xinxiang Medical College, 2007, 24(4): 364-365. 耿明江, 刘振岭, 席荣英, 等. 正交法优选桃花精油的提取工艺[J]. 新乡医学院学报, 2007, 24(4): 364-365. |
| [6] |
Ye Q P, Jin X Y, Xu X D. Research progress on technology methods for extracting jasminum sambac oil[J]. Journal of Tropical Crops, 2014, 35(2): 406-412. 叶秋萍, 金心怡, 徐小东. 茉莉花精油提取技术的研究进展[J]. 热带作物学报, 2014, 35(2): 406-412. |
| [7] |
Li F F, Hu X L. Effect of different extraction methods on Osmanthus oil quality[J]. Amino Acids and Biological Resources, 2012, 34(2): 59-62. 李发芳, 胡西亮. 不同提取方法对桂花精油品质的影响[J]. 氨基酸和生物资源, 2012, 34(2): 59-62. |
| [8] |
Zhang T T, Yang Y H, Wang S Q, et al. Extraction technologies for essential oil of Syringa oblata Lindl. and aroma constituents analysis of Syringa oblata Lindl. at different flowering periods[J]. Hunan Agricultural Sciences, 2011(1): 97-100. 张婷婷, 杨玉红, 王世强, 等. 丁香花精油提取工艺及不同花期香气成分分析[J]. 湖南农业科学, 2011(1): 97-100. |
| [9] |
Tao Q, Xu D X, Lv J Q. Study on the supercritical CO2 fluid extraction of osmanthus fragrans[J]. Food Research and Development, 2007, 28(7): 57-60. 陶清, 徐德虚, 吕鉴泉. 超临界CO2萃取桂花油的工艺研究[J]. 食品研究与开发, 2007, 28(7): 57-60. |
| [10] |
Tian G H, Liu C F, Gu T, et al. Analysis of aroma components from the senescence flow of osmanthus fragrans by GC-MS[J]. Anhui Agricultural Sciences, 2008, 36(17): 7 214-7 216. 田光辉, 刘存芳, 辜天, 等. 衰落桂花香气成分的GC-MS分析[J]. 安徽农业科学, 2008, 36(17): 7 214-7 216. |
| [11] |
Yuan J M, Geng M J, Yan R F, et al. Optimization of ultrasonic-assisted extraction on polyphenols from peach blossom and antioxidant activity evaluation[J]. Food Sci Technol, 2012, 37(12): 179-183. 袁建梅, 耿明江, 闫瑞芳, 等. 超声提取桃花多酚的工艺优化及抗氧化活性研究[J]. 食品科技, 2012, 37(12): 179-183. |
| [12] |
Wang J X. Cosmetics natural functional components[M]. Beijing: Chemical Industry Press, 2007, 177-227. 王建新. 化妆品天然功能成分[M]. 北京: 化学工业出版社, 2007, 177-227. |
 2018, Vol. 40
2018, Vol. 40


