2. 国家林业局 资源昆虫培育与利用重点实验室,云南 昆明 650233
2. Key Laboratory of Cultivation and Utilization of Resources Insects, State Forestry Administration of the P.R. China, Kunming 650233, Yunnan, China
人类食用昆虫已经有数千年的历史,已记录的食用种类超过2 100种[1]。自2003年以来,联合国粮食与农业组织(FAO)积极推动食用昆虫的利用,以保障人类未来食物和饲料安全[2]。食用昆虫作为一种重要的蛋白质来源引起了全球的广泛关注。蜂蜜、蜂花粉、蜂胶、蜂蜡、蜂王浆等以其较高的营养及保健价值已被人类利用了约3 000年[3],尽管蜜蜂幼虫和蛹的食用没有蜂蜜及蜜蜂产品的认知度高,但其食用现象在泰国、墨西哥、厄瓜多尔、斯里兰卡、中国等长期存在[4~8],并深受喜爱。蜜蜂虫体蛋白质含量很高,如意大利蜜蜂幼虫、蛹和成虫的蛋白质含量分别达到35.3%、45.9%和51.0%[9],东方蜜蜂雄蜂的蛋白质含量高达57.60%[10]。同时,蜜蜂虫体的饱和脂肪酸和单一不饱和脂肪酸的组成平衡,铁元素和锌元素的含量高,其幼虫、蛹和成虫都是理想的食物来源[9, 11],开发的潜力十分巨大。
我国云南野生蜜蜂资源丰富,蜜蜂幼虫和蛹的食用历史悠久[12]。蜜蜂幼虫和蛹自蜂巢取出数小时后即变黑腐败,多以包含蜜蜂幼虫和蛹的巢脾或水煮后的幼虫和蛹于当地赶集日销售,俗名多,且多有混淆,难以鉴别。因此,云南食用蜜蜂种类尚无明确的报道。本文对云南南部食用蜜蜂的种类和食用习俗开展调查,通过形态学和mtDNA的细胞色素C氧化酶亚基Ⅰ(COI)基因片段联合鉴定其分类地位,为蜜蜂这一重要资源昆虫的保护和利用提供理论依据。
1 材料和方法 1.1 调查和研究方法云南自然分布的5种蜜蜂(西方蜜蜂为引入)均在横断山脉南端重叠分布[13],构成了当地传统中食用蜜蜂的资源基础。该区域地势由北向南梯层下降,具有帚状水系切割山地,形成较多的山间坝子。山脉的阻断减少了外来影响,也保存了许多少数民族诸如食虫之类的独特文化。该区域海拔多在2 000 m以下,为热带、亚热带气候,年均温度多在18 ℃以上。以该区的普洱、西双版纳、临沧、德宏、保山及周边的红河、玉溪等为调查区域,走访当地农贸市场、赶集日集散地和餐馆,了解当地蜜蜂食用的种类、食用季节、价格和食用方法。于各地市场购买样品,实验室处理后,选取幼虫和蛹未完全煮透、有部分成虫个体的样品,制作成虫标本用于形态学分类鉴定,并提取幼虫和蛹的DNA用于分子鉴定。经过对样品的整理、对比和合并,代表性地选取如下实验材料用于本文研究:①小蜜蜂,购自云南玉溪元江县;②小排蜂和③岩蜂,均购自云南普洱景东彝族自治县;④马岔蜂,购自云南普洱澜沧县;⑤折背蜂(胡蜂),购自云南省普洱市澜沧县,作为外类群。
1.2 主要试剂和仪器设备0.05 mol/L Tris-HCl(pH 8.0),0.1 mol/L NaCl,0.1 mol/L EDTA (pH 8.0),5% (m/V) SDS(pH 7.2),1×TBE,2 g/L蛋白酶K (Thermo scientific公司),Dream Taq PCR Master Mix(2×) (Thermo scientific公司);Trans2K DNA Marker (TRANS公司);DU800型核酸分析仪(Backman Coulter公司);My Cycle PCR扩增仪(BIO-RAD公司);HERMLE Z323K型低温离心机(HERM公司);G:Box HR凝胶成像系统(Syngene公司);POWER-Basic电泳仪(BIO-RAD公司);DYCP 2P-31D电泳槽(北京六一仪器厂);Barnstead NANopure Dlamond超纯水系统(Barstead公司)。
1.3 分子实验方法 1.3.1 DNA提取、PCR扩增及序列测定每种材料分别随机选取15个个体,采用SDS-蛋白酶K消化法提取总DNA[14],DNA经检测后置-20 ℃冰箱保存。PCR扩增mtDNA的COI基因片段,引物C1-J-2410/TL2-N-3038(5′-CCTACAGGAATTAAAATTTTTAGATGA-3′/5′-TCCATTGCACTAATCTGCCATATTA-3′) [15],由上海生工生物工程技术服务有限公司合成。PCR反应体系为50 μL,其中,Dream Taq PCR Master Mix(2×) 25 μL,10 μm/L引物各1.0 μL,DNA模板3 μL,ddH2O 20 μL。反应程序为95 ℃预变性3 min,接着95 ℃变性30 s,50 ℃退火1 min,72 ℃延伸1.5 min,共进行10个循环;95 ℃变性30 s,48 ℃退火1 min,72 ℃延伸1.5 min,共进行25个循环,72 ℃保持10 min,4 ℃保存。产物委托云南硕阳科技有限公司纯化和双向测序。已提交GenBank序列(MF363138~MF363144)及下载序列的登录号见表 1。
|
|
表 1 蜜蜂及胡蜂物种信息 Table 1 Species information of honeybee and wasp |
使用MEGA6软件[16]查看和比对序列,输出各数据组的碱基组成、变异位点、简约信息位点信息;在GenBank数据库Blast搜索序列,获取和比对物种信息;用MEGA6构建邻接法(NJ)和最大简约法(MP)系统发育树,系统树各分支的置信度由Bootstrap 1 000次重抽样检验。
2 结果与分析 2.1 蜜蜂食用及习俗食用蜜蜂是云南南部的普遍现象。食用的虫态主要是幼虫和蛹,偶尔混有极少量成虫。销售形式主要有两种,用热水烫过或煮过的蜜蜂幼虫和蛹一般在当地农贸市场销售,未加工连带巢脾一起销售的多在当地的赶集日临时销售,数量有限。水煮过的蜜蜂幼虫和蛹为黄褐色或深黄褐色,一般以小号饭碗等容器为销售单位;新鲜巢脾每千克20~100元,或每个巢脾15~60元,价格依销售季节、地点、幼虫和蛹的数量等变动。因云南南部气温较高,蜜蜂种群繁育较快,几乎全年均有销售,但以夏季和秋季为主。名称多为蜜蜂、蜂儿、蜜蜂儿、蜂蛹、蜂子等,部分销售者能说出较具体的名称,如小蜜蜂、马岔蜂、小排蜂等,但准确性较低,常有混淆和误用,如,本文的材料小排蜂(东方蜜蜂)是对小蜜蜂俗名的误用(见表 1)。
在云南,蜜蜂和胡蜂的幼虫和蛹都常被称为蜂蛹、蜂儿(子)而容易混淆,但其烹饪方式却有区别。蜜蜂幼虫和蛹最常见的食用方式是凉拌,即用开水烫或煮后,加入芫荽、鱼腥草、茴香叶、辣椒粉及其他调料拌和食用。胡蜂蜂蛹则以油炸为主,极少见到油炸或炒食的蜜蜂幼虫和蛹。这可能是蜜蜂个体较小,从蜂巢中取出油炸的过程繁琐而耗时,而水煮的方式能迅速去除蜂蜡,获得幼虫和蛹,而该区域较为炎热的气候也可能左右着它的利用方式。另外一种受欢迎的蜜蜂虫体食用方式是将未加工的蜂巢或清洗后的蜂蛹放入纱布中挤压,收集挤出的浆汁,加入鸡蛋调和蒸食,或加入竹笋丝等蔬菜煮汤食用,或加入芫荽、花椒粉、食盐等调料拌成稀粥状,用切小的蔬菜蘸食。食用民族不局限于傣族、哈尼族等有食虫风俗的民族,当地拉祜族、彝族、汉族等民族也喜爱食用。市场交易的蜜蜂主要是自然环境中采集的野生资源,采集时,多以明火及产生的烟尘驱散成虫,将蜂巢带回加工。
2.2 蜜蜂食用种类鉴定 2.2.1 形态学鉴定马岔蜂、岩蜂、小排蜂、小蜜蜂和折背蜂的成虫标本,经形态学方式依次鉴定为大蜜蜂(Apis dorsata)、黑大蜜蜂(A.laboriosa)、东方蜜蜂(A.cerana)、小蜜蜂(A. florea)和变侧异腹胡蜂Parapolybia varia varia (Fabricius)。其中大蜜蜂工蜂体长15.40~19.00 mm,中胸宽约4.00~5.00 mm(不含体毛),头部和胸部黑色,被毛,腹部第一和第二节被密集的黄色短毛,其余体节所被短毛颜色加深,多呈黑褐色;黑大蜜蜂工蜂体长16.40~19.80 mm,中胸宽4.40~4.90 mm,体黑色或黑褐色,胸部及腹部第一节密被黄色毛;东方蜜蜂工蜂体长11.10~13.30 mm,中胸宽3.30~3.70 mm,体黑色或黄褐色,腹部各体节端部着生一圈黄色细毛;小蜜蜂工蜂体长8.60~11.00 mm,中胸宽2.40~2.80 mm,黑色,腹部第一和第二背板红褐色。变侧异腹胡蜂体长约13.10~14.50 mm,中胸宽3.00 mm,体黄褐色,头部与胸部宽略等,中胸背板中央两侧各有1长刀状黄色纵斑,足股节、胫节基部色深,腹部第1节长柄状。
2.2.2 分子鉴定除折背蜂外,自市场购买的样品均被热水烫过或水煮过,DNA降解严重,每个样品仅获得少量的DNA。从75个样品中成功提取54个DNA样,PCR扩增成功24个,去除2个有套峰的样,测序得到22个个体的COI基因片段序列。序列校正并去除引物后,马岔蜂、小排蜂和小蜜蜂的序列长度均为600 bp,岩峰和折背蜂的序列长度分别为605 bp、573 bp,A+T的平均含量为76.3%,远高于G+C的平均含量。比对的611个核苷酸位点中,保守位点382个,可变位点229个,简约信息位点227个。
合并相同序列后,在GenBank数据库中进行比对。结果表明,马岔蜂、小蜜蜂和小排蜂的序列与数据库中的序列覆盖度达到100%;但仅有小蜜蜂和小排蜂的序列相似度(一致性)超过99%,能分别确认为小蜜蜂和东方蜜蜂,与形态学鉴定结果一致。因缺少相似度较高的参考序列,马岔蜂、岩峰和折背蜂暂不能通过该序列明确其分类地位,以形态学鉴定结果为准。
以变侧异腹胡蜂为外类群,基于mtDNA的COI基因部分序列,用本研究及GenBank获取的7种蜜蜂共12条序列构建系统发育树(如图 1)。结果表明,系统发育树的拓扑结构区分出了7种蜜蜂,其中,以小蜜蜂和黑小蜜蜂形成的支系——小蜜蜂类群最早分出来,余下的两个单系群分别由大蜜蜂和黑大蜜蜂构成的大蜜蜂类群,以及沙巴蜂、西方蜜蜂和东方蜜蜂构成的穴居蜜蜂类群组成。该结果支持目前普遍认可的蜜蜂属系统发育关系,区分出的三个蜜蜂类群与前人研究[22~24]一致。小蜜蜂类群被认为有较原始的进化地位,在树枝上营单个巢脾,直至进化到防护能力较强、巢脾数量较多的穴居蜜蜂。此外,来自GenBank的序列GQ162109和KC170303分别与东方蜜蜂和小蜜蜂的序列聚在一起,支持了两者的分类地位。
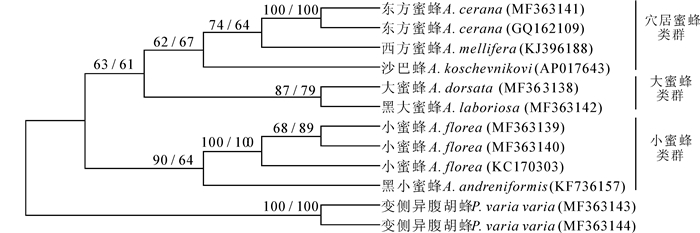
|
图 1 基于线粒体COI基因部分片段的蜜蜂NJ和MP系统发育树 Figure 1 NJ tree and MP tree of honeybees based on partial COI sequence data 注:分枝上的数字分别表示NJ法和ML法的自展值 Note: numbers above the branches refer to neighbor-joining tree bootstrap values/maximum likelihood percent bootstrap support |
目前,全球明确分类地位的蜜蜂属(Apis)有9种蜜蜂,已有5种报道过食用现象,包括东方蜜蜂、西方蜜蜂、大蜜蜂、小蜜蜂和黑小蜜蜂[4~7, 12, 25]。我国分布的6种蜜蜂,云南均有分布,本研究明确了云南传统食用其中的4种蜜蜂,未能确认对西方蜜蜂和黑小蜜蜂的食用。西方蜜蜂是20世纪30年代和60年代大量引进国内的[26],进入云南的时间晚,养殖数量少,本文的调查未能反映其在云南的食用状态。在普洱、德宏、临沧、怒江和红河地区共调查到8 376群黑小蜜蜂[27],数量3倍于黑大蜜蜂的群数,而其(又称小排蜂)在云南的食用亦被李孙洋[28]证实。本文未获得黑小蜜蜂这一材料,可能与其蜂群数的减少和云南特色商品交易的特点有关。云南的“山货”除自家享用外,多由村民在当地特定的赶集日随机销售(各地的赶集日期不同),交易时间较早(特色鲜货多于上午八九点前完成交易),加上收获时间较随意,可能造成了市场调查中该材料的遗漏。综上所述,云南食用本地分布的全部5种蜜蜂,全球食用的蜜蜂种类增加至6种。
3.2 分子鉴定物种的准确鉴定是开展生物学、生态学等研究的基础[29]。与传统分类方法相比,利用基因片段鉴别膜翅目昆虫是一种快速有效的手段,而COI是采用最多的基因[30, 31]。蜜蜂属是一个数量少但非常重要的类群,在对其进行认识的过程中,民间和学术界对其名称常有混用或误用(见表 1),如,黑大蜜蜂的分类地位近年才得到了认可[22],在此之前,它常和大蜜蜂一起被称为岩蜂、排蜂等;而东方蜜蜂也常被误认为小蜜蜂。尽管该类群的部分研究使用了COI序列[32, 33],但包含的种类较少,序列不完整,缺少大蜜蜂、黑大蜜蜂等蜜蜂的线粒体序列信息,影响对蜜蜂的快速鉴定,提示需要通过相关研究补充数据,以提高分子鉴定能力和准确性。
3.3 资源开发与保护云南长期存在多种蜜蜂的食用及商品交易,表明蜜蜂作为一种日常食物资源是可行的。而随着昆虫食用热潮的兴起,蜜蜂食材对增加山区农户的收入是非常有帮助的。但目前,蜜蜂食用资源几乎都来自对自然资源的采集。我国已报道的6种蜜蜂中,仅东方蜜蜂和西方蜜蜂能在单个蜂巢中营多个巢脾,并能人工繁育,其余的种类只营单巢脾[17],无人工养殖的报道,资源数量十分有限。这种“靠山吃山”的做法对自然资源,特别是野生种类的优良遗传资源破坏十分严重。此外,在开发蜜蜂虫体作为食物的过程中,如何平衡其授粉及食用的生态和经济价值;如何减少人类活动对蜜蜂种群增长的影响,如道路增加造成的栖境破碎化,外来蜜蜂引入[26],农药的使用和误用等,都是需要考虑的。因此,开展蜜蜂食用资源的开发需要综合权衡,适地发展,特别是加强人工繁育技术研发,保护遗传资源,才能保障其可持续发展。
致谢:感谢中国林业科学研究院资源昆虫研究所李文良,西南林业大学杨粉珍和罗杨等人在野外调查和试验工作提供的支持和帮助。
| [1] |
Jongema Y. List of edible insects of the world (April 1, 2017)[Z/OL]. 2017-6-7. http://www.wur.nl/en/Expertise-Services/Chair-groups/Plant-Sciences/Laboratory-of-Entomology/Edible-insects/Worldwide-species-list.htm.
|
| [2] |
Van Huis A, VanItterbeeck J, Klunder H, et al. Edible insects: future prospects for food and feed security[M]. Rome: Food and Agriculture Organization of the United Nations (FAO), 2013, 1-162.
|
| [3] |
Mazar A, Panitz-Cohen N. It is the land of honey: beekeeping at Tel Rehov[J]. Near Eastern Archaeology, 2007, 70(4): 202-219. |
| [4] |
Chen P P, Wongsiri S, Jamyanya T, et al. Honey bees and other edible insects used as human food in Thailand[J]. American Entomologist, 1998, 44(1): 24-29. DOI:10.1093/ae/44.1.24 |
| [5] |
Ramos-Elorduy J, Moreno J M P, Prado E E, et al. Nutritional value of edible insects from the state of Oaxaca, Mexico[J]. J Food Compos Anal, 1997, 10(2): 142-157. DOI:10.1006/jfca.1997.0530 |
| [6] |
Onore G. A brief note on edible insects in Ecuador[J]. Ecol Food Nutr, 1997, 36(2-4): 277-285. DOI:10.1080/03670244.1997.9991520 |
| [7] |
Nandasena M R M P, Disanayake D M S K, Weeratunga L. Sri Lanka as a potential gene pool of edible insects[C]// Forest insects as food: humans bite back. Bangkok: Food and Agriculture Organization of the United Nations, Regional Office for Asia and the Pacific, 2010: 161-164.
|
| [8] |
Qian R, Liao C L, Yin D Y. Edible history and current status of honeybee larvae[J]. Jounal of Bee, 1990(3): 4-5. 钱锐, 廖成龙, 尹德元. 蜜蜂幼虫的食用历史及现状[J]. 蜜蜂杂志, 1990(3): 4-5. |
| [9] |
Ghosh S, Jung C, Meyer-Rochow V B. Nutritional value and chemical composition of larvae, pupae, and adults of worker honey bee, Apis mellifera ligustica as a sustainable food source[J]. J Asia Pac Entomol, 2016, 19(2): 487-495. DOI:10.1016/j.aspen.2016.03.008 |
| [10] |
Deng Z L, Fu G M, Xie M Y, et al. Analysis and evaluation of main nutritional components of drone body[J]. Food Science, 2008, 29(9): 560-563. 邓子龙, 付桂明, 谢明勇, 等. 雄蜂蜂体主要营养成分分析与评价[J]. 食品科学, 2008, 29(9): 560-563. |
| [11] |
Finke M D. Nutrient composition of bee brood and its potential as human food[J]. Ecol Food Nutr, 2005, 44(4): 257-270. |
| [12] |
Feng Y, Chen X M, Zhao M. Edible insects of China[M]. Beijing: Science Press, 2016, 241-252. 冯颖, 陈晓鸣, 赵敏. 中国食用昆虫[M]. 北京: 科学出版社, 2016, 241-252. |
| [13] |
He S Y, Kuang H O, Liu Y Q, et al. Natural geographical district of honeybee in China[J]. Journal of Yunnan Agricultural University, 1999, 14(3): 289-293. 和绍禹, 匡海鸥, 刘意秋, 等. 中国蜜蜂资源及自然地理区划研究[J]. 云南农业大学学报, 1999, 14(3): 289-293. |
| [14] |
Dai J X, Yu Y Z, Zheng Z M. Comparative study on genome DNA extraction of Tenebrionidae insects[J]. Journal of Ningxia University (Natural Science Edition), 2004, 25(1): 66-68. 代金霞, 于有志, 郑哲民. 拟步甲昆虫基因组DNA提取的比较研究[J]. 宁夏大学学报(自然科学版), 2004, 25(1): 66-68. |
| [15] |
Juan C, Oromi P, Hewitt G M. Mitochondrial DNA phylogeny and sequential colonization of Canary Islands by darkling beetles of the genus Pimelia (Tenebrionidae)[J]. Proceedings: Biological Sciences, 1995, 261(1361): 173-180. DOI:10.1098/rspb.1995.0133 |
| [16] |
Tamura K, Stecher G, Peterson D, et al. MEGA6: molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [17] |
Kuang B Y, Li Y Q. The species in genus of Apis in China[J]. Apiculture of China, 1986(5): 7-9. 匡邦郁, 李有泉. 中国蜜蜂属(Apis)的种类[J]. 中国养蜂, 1986(5): 7-9. |
| [18] |
Kuang B Y, Li Y Q, Liu Q, et al. Morphometric analysis of two giant honey bees (worker bee) in China[J]. Apiculture of China, 1983(4): 1-2. 匡邦郁, 李有泉, 刘勤, 等. 我国两种大蜜蜂(工蜂)的形态测定分析[J]. 中国养蜂, 1983(4): 1-2. |
| [19] |
Wu Y R. Faunasinica: insecta, volume 20: Hymenoptera: Melittidae, Apidae[M]. Beijing: Science Press, 2000, 370-383. 吴燕如. 中国动物志.第二十卷[M]. 北京: 科学出版社, 2000, 370-383. |
| [20] |
Ren Z J, Sun Q H. Overview of honeybee resources in Tibet[J]. Apiculture of China, 1986(5): 9-11. 任再金, 孙庆海. 西藏蜜蜂资源概况[J]. 中国养蜂, 1986(5): 9-11. |
| [21] |
Li Y Q, Kuang B Y. Classified discussion of six kinds of honeybee[J]. Journal of Bee, 1984(4): 19-21. 李有泉, 匡邦郁. 六种蜜蜂的分类讨论[J]. 蜜蜂杂志, 1984(4): 19-21. |
| [22] |
Cao L F, Niu D F, He S Y, et al. Phylogenetic relationships of honey bees(Hymenoptera: Apinae)inferred from mitochondrial and nuclear DNA sequences[J]. Hereditas, 2012, 34(8): 1057-1063. 曹联飞, 牛德芳, 和绍禹, 等. 基于线粒体和核基因序列的蜜蜂属系统发育分析[J]. 遗传, 2012, 34(8): 1057-1063. |
| [23] |
Engel M S. The taxonomy of recent and fossil honey bees (Hymenoptera:Apidae; Apis)[J]. J Hymenopt Res, 1999, 8(2): 165-196. |
| [24] |
Engel M S, Schultz T R. Phylogeny and behavior in honey bees (Hymenoptera:Apidae)[J]. Ann Entomol Soc Am, 1997, 90(1): 43-53. DOI:10.1093/aesa/90.1.43 |
| [25] |
Chung A Y C. Edible insects and entomophagy in Borneo[C]. Forest insects as food: humans bite back. Bengkok: Food and Agriculture Organization of the United Nations Regional Office for Asia and the Pacific, 2010: 141-150.
|
| [26] |
Yang G H. Harm of introducing the western honeybee Apis mellifera L. to the Chinese honeybee Apis cerana F. and its ecological impact[J]. Acta Entomologica Sinica, 2005, 48(3): 401-406. 杨冠煌. 引入西方蜜蜂对中蜂的危害及生态影响[J]. 昆虫学报, 2005, 48(3): 401-406. |
| [27] |
Liu J P, Tan K. Preservation of Yunnan feral honeybee resources[J]. Journal of Bee, 2013, 33(2): 4-6. 刘建平, 谭垦. 论云南野生蜜蜂资源的保护[J]. 蜜蜂杂志, 2013, 33(2): 4-6. |
| [28] |
Li S Y. Preliminary report on national edible insect resources in Pu'er Yunnan[J]. Southwest China Journal of Agricultural Sciences, 2011, 24(3): 1 195-1 202. 李孙洋. 云南省普洱市民族食用昆虫资源初报[J]. 西南农业学报, 2011, 24(3): 1 195-1 202. |
| [29] |
Dayrat B. Towards integrative taxonomy[J]. Biol J Linn Soc, 2005, 85(3): 407-415. DOI:10.1111/bij.2005.85.issue-3 |
| [30] |
Song N, Liu J, Cai W Z, et al. Application of DNA barcoding in insect taxonomy[J]. Sichuan Journal of Zoology, 2013, 32(3): 470-474. 宋南, 刘杰, 彩万志, 等. DNA条形码在昆虫分类中的应用[J]. 四川动物, 2013, 32(3): 470-474. |
| [31] |
Zhou Q S, Zhang T X, Yu F, et al. Application of DNA barcoding to Hymenopteran taxonomy[J]. Chinese Bulletin of Entomology, 2013, 50(1): 19-28. 周青松, 张同心, 于芳, 等. DNA条形码在膜翅目昆虫中的应用分析[J]. 应用昆虫学报, 2013, 50(1): 19-28. DOI:10.7679/j.issn.2095-1353.2013.003 |
| [32] |
Tanaka H, Suka T, Kahono S, et al. Mitochondrial variation and genetic differentiation in honey bees (Apis cerana, A. koschevnikovi and A. dorsata) of Borneo[J]. Tropics, 2003, 13(2): 107-117. DOI:10.3759/tropics.13.107 |
| [33] |
Tanaka H, Roubik D W, Kato M, et al. Phylogenetic position of Apis nuluensis of northern Borneo and phylogeography of A. cerana as inferred from mitochondrial DNA sequences[J]. Insect Soc, 2001, 48(1): 44-51. DOI:10.1007/PL00001744 |
 2018, Vol. 40
2018, Vol. 40


