2. 南京农业大学 资源与环境科学学院,江苏 南京 210095
2. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
复合氨基酸制剂是利用动植物蛋白质经过化学水解或者微生物酶解制备而成的多组分物质,在工农业生产中的应用十分广泛[1]。菜籽饼粕作为我国比较丰富的蛋白资源,最常用的方式是直接作为农田有机肥和养殖业饲料,这种方式通常会造成蛋白质资源利用率不足的问题。国内研究表明,通过螯合复合氨基酸饲料添加剂或者强化剂,能有效提高动物的生长速度,降低饲料消耗[2]。研究表明,氨基酸肥料与复合氨基酸添加剂,对提高肥料的利用率以及提高烟草等作物品质有非常重要的作用[3]。目前使用的复合氨基酸制剂主要通过动植物废弃蛋白与动物毛发化学水解方式生产,成本较高,且对环境有一定的污染。
利用产蛋白酶微生物酶解途径,采用固体发酵生产氨基酸产品是目前国际上开发利用农业废弃物蛋白质资源的一种有效方法,其技术的关键是筛选能够高效利用废弃物蛋白质的菌株。国内外有较多的报道,筛选出大量产不同蛋白酶的菌株,如枯草芽胞杆菌(Bacillus subtilis),曲霉(Aspergillus)等,并对菌株的生理生化特性和酶学特性进行了研究[4]。由于所用的底物不同,筛选出的微生物都是对底物的利用有单一性的。利用牛奶、豆浆等选择性培养基,从土壤、水体等自然环境以及家禽内脏中分离可利用蛋白质的菌株,通过对菜粕蛋白液态、固态发酵,筛选出高效利用菜粕产氨基酸的菌株具有重要的现实意义,对利用菜粕蛋白资源具有一定的指导作用。
1 材料与方法 1.1 实验材料 1.1.1 材料及来源菜粕(宜兴新天地氨基酸生物肥料有限公司);豆浆(南京双桂食品有限公司);麸皮(南京市场采购);牛奶(南京市场采购);牛津杯(实验室自制)。
1.1.2 培养基① 分离培养基:脱脂牛奶200 mL,牛肉膏2 g,琼脂20 g,水1000 mL,自然pH(牛奶105 ℃灭菌20 min;琼脂、牛肉膏121 ℃灭菌20 min)
② 初筛发酵培养基:豆浆200 mL,NaCl 5 g,葡糖糖10 g,麸皮10 g(水煮15 min取滤液), pH自然,115℃灭菌30 min。
③ 豆浆初筛鉴定培养基:豆浆80 mL,琼脂20 g,链霉素(50 000 U/mL) 0.25 mL,琼脂20 g,pH自然(豆浆分开灭菌121 ℃,20 min,链霉素溶液使用前加入)。
④ 菜粕液体培养基:菜粕80 g,麸皮10 g,淀粉10 g,水1 000 mL,pH 7.2,121℃灭菌30 min。
⑤ 菜粕固体培养基:菜粕900 g,麸皮100 g,NaCO3 1 g,干燥分装于三角瓶,自来水500 mL,(1×105 Pa灭菌40 min)[5]。
1.2 实验方法 1.2.1 样品采集用无菌棉签粘取家禽肠道内容物、土壤、天然水体等少许放入无菌试管中。
1.2.2 菌株分离和纯化的方法将上述试管中加入5 mL无菌水,在摇床170 r/min振荡20 min,从中吸取0.2 mL涂布于分离培养基表面,分别放置于28℃和37℃培养箱中进行培养,24 h后观察是否有水解圈产生及初步观察水解圈的大小,将水解圈大而透明的菌落再次转接到分离培养基进行驯化3次,将一直能够保持较大水解圈、生长迅速的菌株4 ℃低温保存[6]。
1.2.3 菌株初筛的方法① 将分离纯化的菌株分别用初筛发酵培养基37 ℃摇床24 h,取发酵液1.5 mL,3 000 r/min离心15 min,上清液即为粗蛋白酶液。同时将菌株发酵液稀释10倍后用721分光光度计在600 nm处测定OD值,作为发酵液细菌生物量的指标,生长良好的保留,其余的淘汰。
② 将豆浆初筛鉴定培养基在三角瓶中灭菌溶化,与加灭菌豆浆混合,当培养基温度在60 ℃时加入链霉素,混合均匀。迅速用无菌吸管转移10 mL至平皿中,铺展均匀,冷却。每个培养皿中放5个无菌的紫铜牛津杯,成梅花桩排列。每个牛津杯中加入60 μL粗蛋白酶液,在每个培养皿正中设一个对照,加60 μL初筛发酵培养基,37 ℃保温18 h。观察前将0.4 mol/L的三氯乙酸数滴滴到牛津杯附近,5 min后测量水解圈直径,水解圈与OD值的比值大于2.0的作为下一步筛选的重点[7]。
1.2.4 菌株复筛方法将初筛的菌株分别用菜粕液体培养基37 ℃培养24 h,镜检不生长的菌株淘汰掉;将发酵液2 500 r/min离心20 min,取上清液为粗蛋白酶液,按福林酚法测定蛋白酶的活力[8],取上清液10 mL用甲醛滴定法测游离氨基酸含量[9]。
1.2.5 固体发酵菜粕产氨基酸能力测定将菜粕液体发酵复筛中蛋白酶活力高、氨基酸产量高的菌株接种量接种于菜粕固体培养基上,37 ℃培养10天并检测菜粕中氨基酸含量。将固体菜粕2.00 g用10 mL蒸馏水稀释,振荡1.0 h,2 500 r/min离心20 min,取上清液10 mL用甲醛滴定法测游离氨基酸含量。
1.2.6 菌株K11、G12鉴定① 菌体形态学鉴定:将菌接种到初筛平板上,37 ℃培养24 h,观察菌落形态;接种于种子培养基中,37℃、180 r/min摇瓶培养12 h,做芽胞染色,鞭毛染色,革兰氏染色[10]。将培养16~24 h的K11与G12菌体分别以金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)为对照涂片,进行革兰氏染色并观察(采用结晶紫草酸胺染色法)。培养18~36 h的菌体,经5%孔雀绿和0.5%番红染色后镜检,在油镜下观察芽胞和菌体形态(采用孔雀绿藏红染色法);菌体通过透射电镜观察有无鞭毛。
② 菌株总DNA的提取及16S rDNA扩增:在LB培养基中,分别接入活化的细菌,37℃培养12 h,高温SDS裂解法提取其DNA[11]。上游引物序列:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物序列:5′-TACGG(C/T)TACCTTGTTACGACTT-3′。PCR反应体系(25 μL):10×buffer 2.5 μL, 25 μmol/L的MgCl2 0.5 μL,2.5 mmol/L dNTP 0.5 μL,上游引物(10 μmol/L) 0.5 μL, 下游引物0.5 μL, DNA0.5 μL,5 U/μL的Taq酶0.5 μL,超纯水17.5 μL。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性45 s,56 ℃退火30 s,72 ℃延伸1.5 min,循环30次;72 ℃延伸10 min。PCR产物送上海英骏(Invitrogen)生物技术有限公司进行序列测定。
③ 序列比对以及系统发育树的构建:进入美国国家生物技术信息中心(NCBI)站点后,与GenBank数据库中已知的各种微生物序列进行相似性搜索,寻找同源核苷酸序列,确定其种类,用Clustal软件进行进化分析,以邻位相连法(neighbor-joining)建立系统发育树,bootstrap验证次数为2 000[12, 13]。
2 结果与分析 2.1 菌株分离与初筛结果按照分离培养基,分离出90余株细菌初步具有水解蛋白的能力。将分离纯化的90余株细菌进一步进行筛选。由表 1结果可以得出,利用初筛培养基水解圈直径与OD值比值来反应初筛菌株产蛋白酶能力的大小,从90余株细菌中选出13株产胞外蛋白酶的菌株,最终确定7株(G、H、I、J、K、L和M)作进一步复筛。
|
|
表 1 筛选培养基平板上水解圈直径与菌落OD值 Table 1 Diameters of hydrolytic zones on selective culture medium and colony OD value |
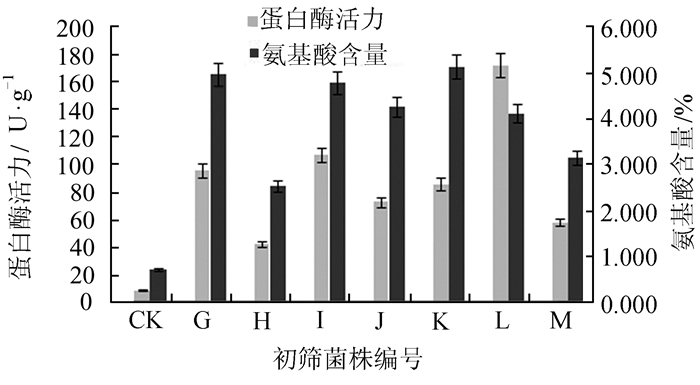
通过对初筛菌株G、H、I、J、K、L和M在菜粕液体发酵培养基中的蛋白酶活力和氨基酸含量的比较,图 1表明G和K菌株的发酵液氨基酸含量最高,但两者的中性蛋白酶的活力比L菌株的蛋白酶活力低,由此推测L菌株蛋白酶对底物的降解具有一定的选择性,对菜粕蛋白的降解效果与G菌株和K菌株相比较差,将G、I、K、L和M几株酶活力较高,游离氨基酸含量相对较高的菌株作为下一步固体发酵降解菜粕蛋白研究的重点。
|
图 1 不同菌株液体发酵产氨基酸及蛋白酶活力比较 Figure 1 Comparison the content of amino acid and protease activity between different strains |
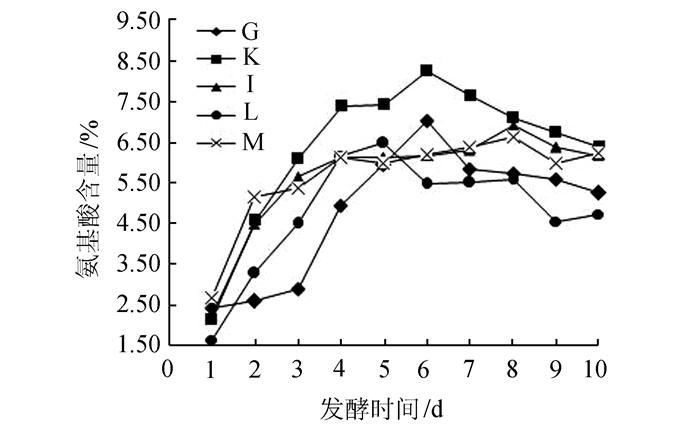
固体发酵实验结果图 2表明G、I、K、L和M不同菌株固体发酵产生的氨基酸含量有明显的差异,G菌株发酵6 d氨基酸含量达到7.0%。K菌株在发酵6 d后发酵物中氨基酸含量最高,达到8.2%(样品烘干测定),发酵后的菜粕固体成黑色,颗粒变小,粘性增加,易黏结成球,臭味中带有芽孢香味。纯种分离K和G菌株,编号为K11与G12,低温冷冻保存备用,L菌株在菜粕蛋白发酵中氨基酸含量比K和G低。
|
图 2 不同菌株固体发酵菜粕游离氨基酸含量的比较 Figure 2 Content of animo acid in rapeseed meal solid fermentation by different strains |
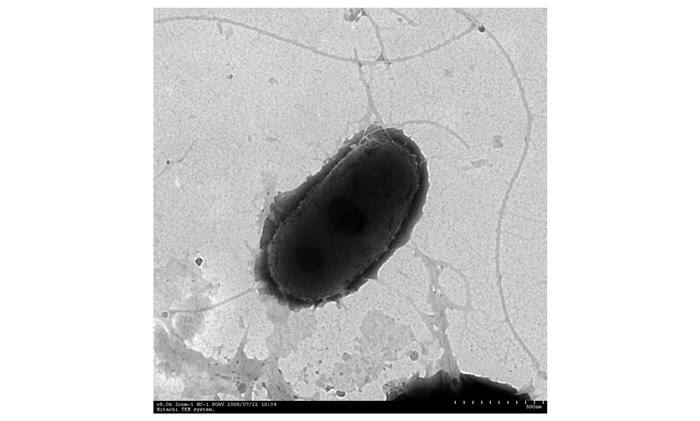
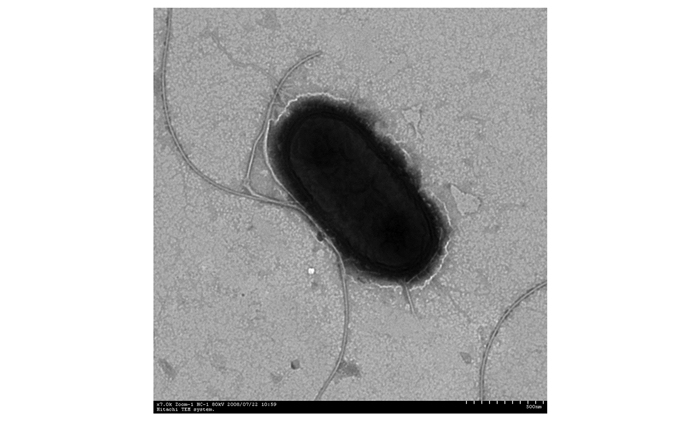
在油镜下观察芽胞和菌体形态,菌株K11菌落周围整齐,表面褶皱粗糙,无粘性,不透明,浅黄色。菌的大小为1.3 μm~1.5 μm×0.9 μm,短杆状,两端钝圆。G12菌体为杆状,在营养琼脂上显示黄色,有氨味,有鞭毛。K11为革兰氏阳性,G12为革兰氏阴性。经5%孔雀绿和0.5%番红染色后镜检,观察到K11产芽胞,G12不产芽胞。图 3透射电镜观察K11菌株,菌体两端钝圆,可能由于样品处理的原因菌体表面鞭毛脱落,图 4看出G12为侧生鞭毛。
|
图 3 Bacillus sp. K11透射电镜(×8000) Figure 3 Bacillus sp.K11TEM image(×8000) |
|
图 4 Stenotrophomonas maltophilia G12透射电镜(×7000) Figure 4 Stenotrophomonas maltophilia G12 TEM image(×7000) |
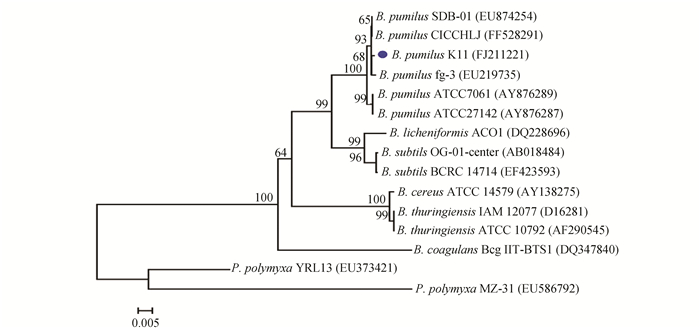
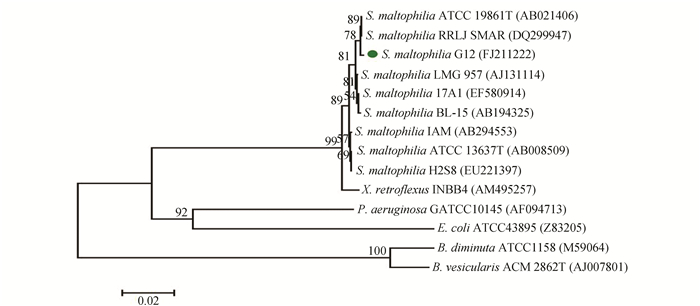
根据Blast结果,选择与K11同源性较高的几株,以及各个种的模式菌株的16S rDNA序列,比对后用软件Mega4.1,以邻位相连法(neighbor-joining)建立系统发育树,bootstrap验证次数为2000,树枝上的数值为验证可信度,图下端标尺表示碱基置换频率[14, 15]。根据图 5结果分析,菌株K11与(Bacillus pumilus.) gf3 (EU219735)相似性为99.7%,初步鉴定K11属于短小芽胞杆菌(Bacillus pumilus)。图 6结果分析G12为嗜麦芽寡养单胞菌(Stenotrophomonas maltrophilia)。
|
图 5 菌株K11及来自GeneBank数据库中相关种的16S rDNA序列系统发育树 Figure 5 Phylogenetic relation 16S rDNA sequence of K11 with 16S rDNA of different strains from GenBank database |
|
图 6 菌株G12及来自GeneBank数据库中相关种的16S rDNA序列系统发育树 Figure 6 Phylogenetic relation 16S rDNA sequence of G12 with 16S rRNA of different strains from GenBank database |
结合形态学特征、生理生化反应特征以及图 5、图 6结果,鉴定细菌K11为短小芽胞杆菌, G12为嗜麦芽寡养单胞菌, 16S rDNA序列提交NCBI数据库GenBank,登录号分别为FJ211221和FJ211222。
3 讨论关于产蛋白酶菌种筛选,国内外有较多的报道。筛选出大量产不同蛋白酶的菌株,如枯草芽胞杆菌,地衣芽胞杆菌(Bacillus licheniformis),嗜麦芽寡养单胞菌,曲霉等,并对蛋白酶的性质进行了深入研究。然而国内外就食品、饲料工业方面的研究主要集中在真菌产生蛋白酶方面,而对细菌发酵生产蛋白酶研究的较少[16, 17]。关于菜粕蛋白酶解的研究,集中在蛋白质改性后在饲料中的应用,其中筛选枯草芽胞杆菌用于菜粕固体发酵,已经初步验证了其良好的菜粕蛋白改性效果[18]。邱鑫等[19]筛选凝结芽胞杆菌(Bacillus coagulans)和圆胞芽胞杆菌(Bacillus globisporus)混合发酵,在12.5 kg菜粕,含水质量分数60%、饼粕基质pH值为6,发酵温度为35℃能充分降解饼粕中所含的粗蛋白,使其质量分数下降到8.9%左右。虽然细菌蛋白酶的种类较多,但对水解的底物有着高度的专一性,所以筛选时要以最终降解底物能力为依据。从图 1中可以得出,G和K蛋白酶活比菌株L低,但水解菜粕的能力强于菌株L,在发酵过程中高浓度的氨基酸可能会对蛋白酶的合成有反馈抑制作用,由于测定蛋白酶的条件是中性,也可能G和K菌株所产生的蛋白酶为非中性蛋白酶。综合结果表明,菌株K11无论在液体还是固体状态下都能高效地利用和水解菜粕粗蛋白,G对菜粕的水解能力次之。
研究基于筛选高效蛋白酶产量高的细菌菌株,水解菜粕蛋白生产复合氨基酸的目的,采用牛奶酪蛋白、大豆蛋白、菜粕粗蛋白为底物进行初筛和复筛,可以确保所筛菌株能高效水解菜粕粗蛋白。筛选出的产蛋白酶的细菌菌株G12和K11,经过菜粕液体、固体发酵水解菜粕粗蛋白的能力的研究,定量测定蛋白酶活力和氨基酸含量,表明最终G12和K11可以在菜粕、麸皮培养基上迅速生长,分泌大量胞外蛋白酶将菜粕粗蛋白水解成游离氨基酸和小肽的。G12发酵后的菜粕、麸皮混合物氨基酸含量达到7%,另外一株来自于鸡的肠胃,在菜粕90%、麸皮10%的培养基中生长迅速,发酵后的混合物中氨基酸含量可达到8.2%,这是目前研究利用细菌蛋白酶水解菜粕蛋白比较高效的菌株。研究获得高产蛋白酶的细菌菌株,弥补对细菌产蛋白酶研究的不足。同时,本研究就扩大微生物菌种资源的开发和菜粕蛋白生产复合氨基酸制剂,具有一定的指导意义和实际意义。今后有必要对G12和K11菌株利用菜粕粗蛋白制备复合氨基酸工艺条件做进一步的优化研究,进一步提高游离氨基酸的得率。
| [1] |
Gao W H, Li G J, Yu SH J, et al. Hydrolyzed vegetable protein[J]. Food Science, 2000, 21(12): 167-170. 高文宏, 李国基, 于淑娟, 等. 水解植物蛋白[J]. 食品科学, 2000, 21(12): 167-170. DOI:10.3321/j.issn:1002-6630.2000.12.059 |
| [2] |
Sun D C, Wang S Q, Zhao Z G, et al. The effect of trace element amino acid chelate on production performance of laying hens[J]. China Feed, 1995(1): 14-15. 孙德成, 王守清, 赵志恭, 等. 微量元素氨基酸螯合物对产蛋鸡生产性能的影响[J]. 中国饲料, 1995(1): 14-15. |
| [3] |
Zhang X H, Yang C J, Wang S K, et al. Impact on later-stage nitrogen supply and leaf quality in tobacco field after rapeseeds cake applied to flue-cured tobacco[J]. Journal of Yunnan Agricultural University, 2004, 19(1): 95-99. 张晓海, 杨春江, 王绍坤, 等. 烤烟施用菜籽饼对烟田土壤后期供氮及烟叶品质的影响[J]. 云南农业大学学报, 2004, 19(1): 95-99. |
| [4] |
Zhang S Z. Enzymes industry[M]. Beijing: Science Press, 1998, 650-658. 张树政. 酶制剂工业[M]. 北京: 科学出版社, 1998, 650-658. |
| [5] |
Li F D. Experimental techniques of agricultural microbiology[M]. Beijing: China Agriculture Press, 1996, 45-48. 李阜棣. 农业微生物实验技术[M]. 北京: 中国农业出版社, 1996, 45-48. |
| [6] |
Zhang L X, Zhang T, Li L Y. Methods and techniques of biochemical experiment[M]. Beijing: Higher Education Press, 1997, 12-15. 张龙翔, 张庭, 李令缘. 生化实验方法与技术[M]. 北京: 高等教育出版, 1997, 12-15. |
| [7] |
Shen P. Microbiology experiment[M]. Beijing: Higher Education Press, 1989, 47-50. 沈萍. 微生物学实验[M]. 北京: 高等教育出版社, 1989, 47-50. |
| [8] |
Zhuge J, Wang Z X. Manual of Technical test technology of industrial microbiology[M]. Beijing: China Light Industry Press, 1994, 205-209. 诸葛健, 王正祥. 工业微生物试验技术手册[M]. 北京: 中国轻工业出版社, 1994, 205-209. |
| [9] |
Chen Q. Handbook of modern bacteriological media and biochemical experiment[M]. Beijing: Chinese Science and Technology Press, 1993, 89-103. 陈奇. 现代细菌学培养基和生化试验手册[M]. 北京: 中国科学技术出版社, 1993, 89-103. |
| [10] |
Chen H K. Microbiology experiment[M]. Beijing: Agriculture Press, 1962, 16-19. 陈华葵. 微生物学实验[M]. 北京: 农业出版社, 1962, 16-19. |
| [11] |
Zhen W, Quan C S, Piao Y Z, et al. A speedy extraction method for bacterial chromosomal DNA[J]. China Biotechnology, 2006, 26(4): 75-80. 郑维, 权春善, 朴永哲, 等. 一种快速提取细菌DNA的方法研究[J]. 中国生物工程杂志, 2006, 26(4): 75-80. |
| [12] |
Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution, 1987, 4: 406-425. |
| [13] |
Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap[J]. Evolution, 1985, 39: 783-791. DOI:10.1111/j.1558-5646.1985.tb00420.x |
| [14] |
Tamura K, Nei M, Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method[J]. Proceedings of the National Academy of Sciences, 2004, 101: 11 030-11 035. DOI:10.1073/pnas.0404206101 |
| [15] |
Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24: 1596-1599. DOI:10.1093/molbev/msm092 |
| [16] |
Agrawal D, Patidar P, Banerjee T, et al. Production of alkaline protease by Penicillium sp. under SSF conditions and its application to soy protein hydrolysis[J]. Process Biochem, 2004, 39(8): 977-981. DOI:10.1016/S0032-9592(03)00212-7 |
| [17] |
Nonaka T, Fujihashi M, Kita A, et al. The crystal structure of an oxidatively stable subtilisin-like alkaline serine protease, KP-43, with a C-terminal beta-barrel domain[J]. Briochem, 2004, 279(45): 84-90. |
| [18] |
Liu A H, Liang Y X. Studies on screening of bacteria producing cellulase and modification of rapeseed protein[J]. Hubei Agricultural Sciences, 2007(46): 824-827. 刘爱华, 梁运祥. 产纤维素酶细菌的筛选及在菜粕蛋白改性上的应用[J]. 湖北农业科学, 2007(46): 824-827. |
| [19] |
Qiu X, Xiao H Q, Xiang T Y, et al. Screening, identification and fermentation conditions of the crude protein-degradative strain[J]. Amino Acids and Biotic Resources, 2005, 27(1): 1-5. 邱鑫, 肖汉乾, 向天勇, 等. 菜籽饼粕粗蛋白降解菌的筛选、初步鉴定与发酵条件摸索[J]. 氨基酸和生物资源, 2005, 27(1): 1-5. |
 2018, Vol. 40
2018, Vol. 40


