家蚕,又称桑蚕(Bombyx mori Linnaeus),属鳞翅目(Lepidoptera)蚕蛾科(Bombycidae),是鳞翅目模式昆虫,具有重要的经济价值,家蚕饲养历史在中国逾5 000年[1],从农耕社会至今,为人类社会经济发展做出了巨大的贡献。中国生丝产量稳居世界之首,占世界总产量80%以上。同其他经济动植物一样,病害为蚕桑行业带来巨大的损失,同时降低茧丝质量,严重影响我国丝质品在国际市场上的竞争力。以蚕桑生产大省广西为例,2014年广西蚕茧总产量占全国产量42.9%,产值1 033 032万元(农业部种植业管理司经作处),该省每年因蚕病危害造成蚕茧减产约15%~20%[2]。
家蚕病害由病毒,细菌,真菌和微孢子引起。家蚕细菌病害发病率高,可以和病毒协同或者单独发病,虽然通常很少大规模爆发,但当家蚕体质赢弱时就会发生,对蚕桑业造成巨大损失。已报道的家蚕病原菌有芽胞杆菌(Bacillus spp.),包括苏云金芽胞杆菌(B. thuringiensis)、枯草芽胞杆菌(B. subtilis)、蜡样芽胞杆菌(B. cereus)、黑胸败血芽胞杆菌(B. bombyseptieus); 葡萄球菌(Staphylococcus spp.),如白色葡萄球菌(S. albus)和金黄色葡萄球菌(S. aureus); 此处还有粘质沙雷氏菌(Serratia marcescens)、蒙氏肠球菌(Enterococcus mundtii)、克雷伯氏阴沟菌(Klebsiella cloacae)、阴沟气杆菌(Aerobacter cloacae)、德尔马瓦无色杆菌(Achromobacter delmarvae)、微球菌(Micrococcus spp.)和变形杆菌(Proteus spp.)等[3~5]。家蚕病原细菌的分离鉴定为精准防控家蚕病害提供参考,有助于减少病害对蚕业生产造成的损失。
本研究在广西鹿寨采集自然感染病蚕样本,进行家蚕病原细菌的分离和鉴定。鉴于野外昆虫病害在桑叶的介导下,可以传播给家蚕,尤其是鳞翅目害虫的病原菌,可能在家蚕饲养过程中累积,本研究进一步测试了家蚕病原细菌对鳞翅目害虫棉铃虫(Helicoverpa armigera)和黏虫(Mythimna separate)的杀虫活性,以评估家蚕病原细菌在农林害虫生物防治上的潜力,以期将家蚕病原细菌变害为宝,作为生物资源开发利用。本研究结果也在一定程度上印证,家蚕病原菌的可能来源。
1 材料与方法 1.1 实验材料① 家蚕:春蕾×镇珠,湖北省农业科学院经济作物研究所蚕桑课题饲养。
② 棉铃虫:湖北省农业科学院生物农药工程研究中心提供。
③ 粘虫:华中农业大学植物科技学院城市与园艺昆虫学研究所提供。
1.2 实验试剂LB培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g;用ddH2O定容至1 L,用5 mol/L NaOH调节pH至7.0~7.2,121 ℃灭菌20 min,用于菌株的活化和增殖。固体LB培养基,在以上的基础上另加入1.5%~2%的琼脂粉。
棉铃虫饲料:酵母粉4.0 g,黄豆粉7 g,维生素C 0.5 g,琼脂条1.5 g,36%醋酸1.25 mL,水100 mL。
粘虫饲料:玉米叶粉40 g,纤维素60 g,大豆粉40 g,酵母粉40 g,干酪素10 g,蔗糖15 g,对羟基苯甲酸酯3 g,山梨酸1 g,抗坏血酸3 g,复合维生素1片,肌醇0.3 g,琼脂20 g,加水680 mL搅拌。
PBS缓冲液:NaCl 7.9 g,KCl 0.2 g,Na2HPO4 1.42 g,KH2PO4 0.27 g,溶解于1 L去离子水中,用5 mol/L NaOH调至pH 7.2~7.4,121 ℃灭菌20 min。
STE缓冲液:0.1 mol/L NaCl,10 mmol/L Tris-HCl (pH 8.0),1 mmol/L EDTA (pH 8.0),121 ℃灭菌30 min,用于菌体细胞的洗涤。
溶液Ⅰ:1 mol/L Tris-HCl (pH 8.0),0.5 mol/L EDTA (pH 8.0),50 mmol/L葡萄糖,0.25 μm的滤膜过滤除菌,4 ℃保存。
1.3 家蚕病原菌分离验证取自然感染的病蚕,75%酒精体表消毒,无菌水冲洗后装入无菌离心管,无菌操作下挑取家蚕样品组织,涂布LB平板,28 ℃培养过夜,挑取单菌落,转接液体LB培养基,28 ℃培养8~12 h,用作总DNA抽提,培养至芽胞形成留作生物测定。
家蚕病原菌分离验证参照柯赫法则[6],即液体培养分离株穿刺感染5龄第3 d健康家蚕,处理3组每组20只家蚕,无菌PBS溶液注射组作为对照,25 ℃常规饲养,记录72 h死亡率及临床病状。再次分离感染病蚕体内病原菌,16S rDNA测序分析比对。
1.4 总DNA抽提取1 mL菌液,12 000 r/min离心1 min去上清,400 mL STE打散,12 000 r/min离心1 min吸净上清,加150 μL溶液I打散,加入10 μL溶菌酶(50 mg/mL),冰上静置3~4 h,加300 μL 0.2% SDS混匀,55~60 ℃震荡温育30~60 min,直到溶液清亮。加入150 μL 5mol/L NaCl混匀,冰上静置5~10 min,加入等体积苯酚:氯仿:异戊醇(25:24:1)抽提两次,12 000 r/min离心5 min弃上清,加入两倍体积无水乙醇沉淀,-20 ℃ 2~3 h后12 000 r/min离心15 min弃上清,70%乙醇洗涤沉淀,12 000 r/min离心10 min弃上清,室温干燥,20~50 μL ddH2O溶解沉淀,-20 ℃保存。
1.5 16S rDNA基因序列分析通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)用于扩增16S rDNA及扩增产物测序[7]。
测序结果使用Seqman软件拼接矫正不一致碱基,所得16S rDNA序列与greengenes(http://greengenes.secondgenome.com)及RDP(http://rdp.cme.msu.edu/)数据库比对,然后加入分离株比对结果中序列一致性较高的种属标准菌株,CLUSTAL W软件[8]比对所有分离株及标准菌株序列(www.dsmz.de/home.html),MEGA 4.0软件邻接法[9](neighbor-joining, NJ, bootstrap 1000)构建系统发育树。聚类所用标准菌株16S rDNA序列来自NCBI GenBank,标准菌株编号蜡样芽胞杆菌ATCC 14579(索取号:KY034377.1),巨大芽胞杆菌(Bacillus megaterium)ATCC 14581(索取号:NZ_CP009920.1, Locus tag: BG04_RS09645),短小芽胞杆菌(Bacillus pumilus) ATCC 7061(索取号:NR_043242.1),枯草芽胞杆菌(Bacillus subtilis)ATCC 6051(索取号:CP003329.1, Locus tag: BSU6051_0082022),苏云金芽胞杆菌ATCC 10792(索取号:NR_114581.1),贝莱斯芽胞杆菌(Bacillus velezensis) LMG 22478(即B. velezensis CR-502,索取号:AY603658.1)。
1.6 对鳞翅目害虫活性测试以初孵棉铃虫幼虫和粘虫幼虫作为毒力测定的目标生物,在24孔板上进行毒力测定。每孔加饲料950 μL,晾干饲料。LB培养分离株至芽胞形成,每孔饲料表面加100 μL芽胞原液(约1013 CFU/mL),对照组使用无菌LB涂布饲料,晾干后每孔加一只初孵幼虫,每种虫设3组重复,每组24只虫。26 ℃条件下培养,记录感染供试幼虫死亡情况。
棉铃虫浓度梯度实验,将分离株芽胞原液稀释至原液的75%、50%、25%和10%,同上述方法加入饲料表面,饲养3 d后记录死亡率,饲养7 d后,对处理组和对照组棉铃虫称重。
2 结果与分析 2.1 家蚕病原菌的验证和鉴定从自然感染的病蚕组织分离得到LZ10-1,穿刺感染5龄蚕24 h后死亡率100%,且发病症状与自然感染症状一致,穿刺感染蚕体再次分离所得菌株与LZ10-1 16S rDNA序列一致,表明该LZ10-1是家蚕高致病力病原菌。
16S rDNA序列比对结果表明,菌株LZ10-1属于芽胞杆菌属,LZ10-1 16S rDNA序列提交GenBank注册,索取号MG551954。将菌株LZ10-1 16S rDNA序列与1.4所列芽胞杆菌属标准菌株16S rDNA序列聚类进行系统发育分析,结果显示LZ10-1与标准菌株蜡样芽胞杆菌ATCC14579和苏云金芽胞杆菌ATCC 10792聚于同一分支,与蜡样芽胞杆菌ATCC14579亲缘关系最靠近(图 1A)。

|
图 1 LZ10-1 16s rDNA序列分析和形态学观察 Figure 1 16S rDNA sequence analysis and morphologic observation of strain LZ10-1 注:A,LZ10-1 16s rDNA系统发育树聚类分析;B,LZ10-1芽胞形成期的形态学观察;实心箭头所指为成熟的芽胞,空心箭头所指为正在形成芽胞的细胞 Note: A, phylogenetic analysis of strain LZ10-1 based on 16S rDNA sequences; B, the morphologic observation of strain LZ10-1;the solid arrow refers to mature spores and the hollow arrow refers to a cell that is forming spore |
由于蜡样芽胞杆菌和苏云金芽胞杆菌的16S rDNA序列相似性极其高,仅凭16S rDNA序列分析很难鉴定到具体种,但苏云金芽胞杆菌能形成伴胞晶体,故进一步进行LZ10-1芽胞形成期的形态学观察,以确定其具体的种。形态学观察结果表明,LZ10-1营养体呈长杆状,芽胞成熟后无伴胞晶体形成(图 1B)。结合16S rDNA分析结果和形态学观察结果,菌株LZ10-1应为蜡样芽胞杆菌。
2.2 对鳞翅目害虫的杀虫活性鉴于芽胞杆菌属细菌具有多种杀虫活性,本研究进而测试了LZ10-1对鳞翅目害虫棉铃虫和黏虫的杀虫活性。饲料涂布法饲喂初孵幼虫结果表明,LZ10-1芽胞原液对棉铃虫和黏虫具有很高的杀虫活性,棉铃虫幼虫在第3 d全部死亡,黏虫幼虫也在第4 d全部死亡(图 2A)。
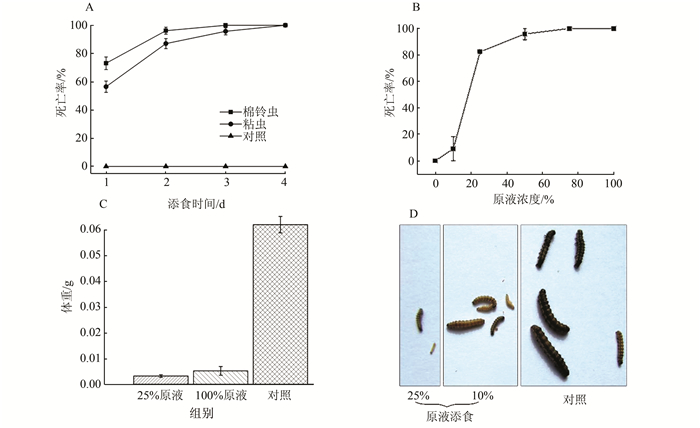
|
图 2 LZ10-1对棉铃虫和粘虫的杀虫活性 Figure 2 Insecticidal activity of LZ10-1 against the cotton bollworm Helicoverpa armigera and armyworm Mythimna separate 注:A, LZ10-1对棉铃虫和粘虫初孵幼虫的杀虫活性分析;B,LZ10-1芽胞对棉铃虫毒杀活性3 d内的量效曲线;C和D,低剂量的LZ10-1芽胞7 d内对棉铃虫生长的抑制作用。各实验设3个重复,每个点的数值是3个重复的平均值,误差线为3个重复间的标准差 Note: A, insecticidal activity of LZ10-1 against the newly hatched larvae of Helicoverpx armigera and Mythimna separate; B, dose-response curve of LZ10-1 spores against H. armigera within 3 d; C and D, inhibitory effect of low concentration LZ10-1spores on the growth of H. armigera within 7 d. Error bars represent the standard deviation within three independent experiments. Each data point represents the average of the 3 repeated experiments |
进一步测试棉铃虫添食不同浓度LZ10-1芽胞悬液后的响应,100%、75%、50%、25%和10%五个浓度的LZ10-1芽胞悬液添食处理棉铃虫3 d后,矫正死亡率9.14%~100%,在10%~25%芽胞悬液区间有急剧上升,杀虫活性与芽胞浓度有相关性(图 2B)。LZ10-1芽胞悬液添食处理棉铃虫7 d后,仅10%和25%芽胞悬液处理组有棉铃虫幸存,且与对照组相比体重体色有明显差异,幸存棉铃虫表现出明显生长抑制,生长抑制程度也与添食芽胞浓度有相关性(图 2C, D)。以上结果表明较高浓度的LZ10-1芽胞悬液对棉铃虫和黏虫具有杀虫活性,低浓度下则会表现出明显的生长抑制。
3 讨论本研究从自然感染病蚕样本中分离得到高致病力家蚕病原菌LZ10-1,结合16S rDNA分析结果和形态学观察结果,菌株LZ10-1应为蜡样芽胞杆菌。接近全长的16S rDNA序列为微生物分类提供可靠的信息[10],但有的种间16S rDNA序列高度相似时,无法仅凭16S rDNA的结果确定种,还需要结合传统形态学的观察,甚至生理生化指标,才能做出精确的判断。该病原细菌的分离鉴定,可以为采样地家蚕病害的精确防治提供理论依据,并为其他昆虫病原菌研究提供参考。
家蚕以桑叶为食,野外昆虫病害在桑叶的介导下,可以传播给家蚕,尤其是鳞翅目害虫的病原菌,可在家蚕饲养过程中累积,故而自然感染的病蚕样本中也能分离到对农业害虫具有杀虫活性的微生物。本研究的结果验证了家蚕病原菌对农业害虫的杀虫活性。此外,鳞翅目昆虫是地球上比例最大的动物之一,其中大部分是害虫[11],家蚕作为鳞翅目模式昆虫,其病原菌也是其他鳞翅目害虫的潜在病原菌。我国桑园面积82.18万hm2[12],养蚕农户1 000多万户,涉及全国26个省市区,各地气候生态条件迥异,可能造成家蚕病原菌的多样性。家蚕病原菌有望为防治农林害虫提供更多样的生物资源,以满足农林害虫生物防治中的多种需求。
本研究结果中LZ10-1对鳞翅目害虫棉铃虫和粘虫具有高杀虫活性,证明家蚕病原细菌具有生物防治农林害虫的潜力,有作为杀虫资源进行开发利用的价值。家蚕病原细菌生防潜力的发掘,能提高蚕桑行业现有资源利用,是拓展行业发展新方向的有益探索。以LZ10-1为模型,深入研究其杀虫机制,可进一步测试家蚕病原菌的杀虫谱,尤其是对鳞翅目之外其他昆虫的杀虫活性。考察LZ10-1对非靶标生物的安全性,并在其应用上探讨趋利避害的技术措施,在防治农林害虫的同时减免对有益昆虫的影响,为家蚕病原细菌作为生防资源开发利用,做好充分的理论基础。
| [1] |
Xia Q, Guo Y, Zhang Z, et al. Complete resequencing of 40 genomes reveals domestication events and genes in silkworm (Bombyx)[J]. Science, 2009, 326(5951): 433-436. DOI:10.1126/science.1176620 |
| [2] |
Bi L. The prevention and control of main silkworm disease in Guangxi[J]. Guangxi Sericulture, 2005(4): 10-14. 闭立辉. 广西当前主要蚕病与防治[J]. 广西蚕业, 2005(4): 10-14. |
| [3] |
Cappellozza S, Saviane A, Tettamanti G, et al. Identification of enterococcus mundtii as a pathogenic agent involved in the "flacherie" disease in Bombyx mori L. larvae reared on artificial diet[J]. J Invertebr Pathol, 2011, 106(3): 386-393. DOI:10.1016/j.jip.2010.12.007 |
| [4] |
Priyadharshini P, Mahalingam C A, Shashidhar K R. Identification and characterization of bacterial pathogens in silkworm, Bombyx mori L[J]. Current Biotica, 2008, 2(2): 181-192. |
| [5] |
Huang L, Cheng T, Xu P, et al. A genome-wide survey for host response of silkworm, Bombyx mori during pathogen Bacillus bombyseptieus infection[J]. PLoS One, 2009, 4(12): e8098. DOI:10.1371/journal.pone.0008098 |
| [6] |
Singh V P, Proctor S D, Willing B P. Koch's postulates, microbial dysbiosis and inflammatory bowel disease[J]. Clin Microbiol Infect, 2016, 22(7): 594-599. DOI:10.1016/j.cmi.2016.04.018 |
| [7] |
DeLong E F. Archaea in coastal marine environments[J]. Proc Natl Acad Sci U S A, 1992, 89(12): 5 685-5 689. DOI:10.1073/pnas.89.12.5685 |
| [8] |
Thompson J D, Higgins D G, Gibson T J. CLUSTALW_ Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice[J]. Nucleic Acids Res, 1994, 22(22): 4 673-4 680. DOI:10.1093/nar/22.22.4673 |
| [9] |
Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Mol Biol Evol, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
| [10] |
Yarza P, Yilmaz P, Pruesse E. Uniting the classification of cultured and uncultured bacteria and archaea using 16S rRNA gene sequences[J]. Nat Rev Microbiol, 2014, 12(9): 635-645. DOI:10.1038/nrmicro3330 |
| [11] |
Wu K, Yang B, Huang W, et al. Gut immunity in Lepidopteran insects[J]. Dev Comp Immunol, 2016, 64: 65-74. DOI:10.1016/j.dci.2016.02.010 |
| [12] |
Feng H S, Li J Q. The development of Chinese sericulture in 12th Five-Year and the prospect of Chinese sericulture in "13th Five-Year"[J]. China Sericluture, 2016, 37(1): 4-10. 封槐松, 李建琴. 我国蚕桑产业发展"十二五"回顾和"十三五"展望[J]. 中国蚕业, 2016, 37(1): 4-10. |
 2018, Vol. 40
2018, Vol. 40


