辽河油田是我国最大的稠油生产基地[1],地质条件、油藏类型及开采方式复杂多样,其中欢喜岭采油区开发目的层主要为莲花油层,埋藏较深,属于高孔、高渗储层,开采难度大,为提高稠油采收率,应用蒸汽吞吐驱(SS)、蒸汽驱(SF)及聚合物驱(PF)等开发方式,主要以SS和SF为主[2]。蒸汽腔是汽驱开发的主要特征,受到油层间非均质性、沉积微相及地层倾角等因素影响,沿着高渗透率、厚层、储层物性好、地层倾角大及构造高部位等方向波及[3]。另根据热连通、驱替、蒸汽突破及蒸汽剥蚀4个阶段[4],蒸汽在纵向和平面不同程度扩展,使稠油藏形成一种独特的暗生态环境。伴随热采开发,部分井口发现高浓度硫化氢。研究结果显示,硫化氢成因与微生物有关,即生物量热裂解/热还原产硫化氢(BTDS/BBR)[5],同时也发现多种参与硫循环的硫氧化和还原菌[6, 7]。
油藏微生物在地下环境中扮演十分重要的角色。硫循环菌不仅可直接参与硫化氢的产生,其代谢产物或分泌物可引起油藏酸化和对金属的腐蚀,往往造成管线的堵塞,甚至锈蚀穿孔[8, 9],也间接影响采油效率。碳循环菌一方面通过代谢对岩石和原油产生积极作用,提高石油采收率,另一方面以石油为碳源,通过酶催化作用将长链烃降解为短链烃,最终产物为二氧化碳和水[10]。氮循环微生物参与氮的硝化、反硝化及氨氧化等反应[11]。因此,有必要深入探究油藏内部微生物群落,尤其是经不同开发方式作用后,油藏内温度、压力及稠油性质等发生变化,可能会引入新的电子受体、供体和外源微生物[12]。
目前,关于油藏微生物群落结构和多样性分析方法较多,除了少部分聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)和克隆文库等分析外,主要集中在第二代高通量测序技术上,包括16S rDNA高通量测序和宏基因组测序,研究包括微生物群落结构、多样性、功能特征、相互协作关系及与环境之间的关系等[12, 13]。有关辽河稠油藏微生物资源的报道,万云洋等[14]应用PCR-DGGE法快速分析稠油藏复杂地层条件下微生物多样性,初步表明不同开发方式的微生物多样性和丰度不相同。万云洋等[15]又利用高通量测序方法对稠油藏微生物群落进行分析,结果显示油藏内有丰富的古菌和细菌资源。但以上研究缺少直观的微生物群落总体活性与代谢功能的信息,可引入佰珞(Biolog)技术作为补充[16],该技术在环境微生物群落的研究中应用较多[17~21],但无油藏内微生物群落功能多样性研究报道,仅涉及到石油污染土壤和地下水等领域[22, 23]。因此,为了弥补上述研究的不足,本文将佰珞生态(Biolog-ecology,Biolog-ECO)技术运用到油藏领域中,探讨不同区块内地层水微生物利用碳源情况,深入了解油层生态系统中微生物群落总体代谢活性,以得到更为全面的油藏微生物多样性信息。
1 实验材料和方法 1.1 研究区概况和样品采集采样区分为齐40、齐108及欢2区块。齐40区块位于辽河断陷西部凹陷西斜坡南端。开发目的层为沙三下莲花油层,采样井包括L2SHC23、L2SHC024、L2SHCH7及L2SHC241,原始地层温度37 ℃,蒸汽腔温度范围150~290 ℃,均为SF开发(表 1)。除L2SHCH7外,其余采样井均发生过驱替变化,SS开发比SF开发多一个焖井阶段,促进蒸汽与油藏岩石热交换程度,但两者均属于热采方式。齐108块位于辽河断陷盆地西部凹陷西斜坡中段欢曙上台阶的上倾部位,地处欢喜岭油田采油区北部,西靠齐40区块,开发主要目的层为沙三段莲花油层,采样井包括L2SHC02、L2SHC04及L2SHC06,原始地层温度46 ℃,蒸汽腔温度范围280~350 ℃,均为SS开发。欢2区位于欢喜岭采油区西部,开发主要目的层为沙三段大凌河油层。采样井为L2SHC3104,原始地层温度61 ℃,为PF开发,发生过驱替变化。采样时间为2014年8月27日,分别收集各井口采出液样品,包括油水混合物,每个样品采集1L装入灭菌的玻璃试剂瓶中,待油水静止分层后,取地层水用于Biolog-ECO分析。
|
|
表 1 采样井地质信息及开发历史 Table 1 Geological information and exploitation history of sampling well |
应用微孔板中的碳源底物来评价微生物生理代谢特征[24]。本研究采用含31种碳源的生态板分析微生物群落的代谢活性和多样性,接种液的制备参照Smalla等[25]的研究方法,将上述稀释液加入到生态板中,每孔150 μL,每个样品3次重复,置于20 ℃恒温培养箱中培养,4 h后进行初始读数,后续每隔24 h在微孔板读数仪上测量590 nm波长下的吸光值[26]。
1.3 地层水微生物群落功能多样性计算颜色平均变化率(AWCD)用来评估地层水微生物群落对碳源利用的能力,其计算公式为:AWCD=Σ(Ci-R)/n[16],式中:Ci为第i个有培养孔的吸光值;R为对照孔的吸光值;n为培养基碳源总数,本研究中n为31。
香农-威纳多样性指数(H′)[27],用来评估微生物物种的丰富度,其计算公式为:H′=-Σ(Pi\5lnPi)[28], 式中:Pi为第i个有培养基与对照孔的吸光值差与整板总差的比值,即Pi=(Ci-R)/Σ(Ci-R)。
辛普森优势度指数(D)[29]用来评估物种的优势度,其计算公式为:D=1-ΣPi2[28],Pi含义同H′公式中所述。
皮卢均匀度指数(J)[30]是微生物群落实测多样性与最大多样性的比率,通过H′值计算,其计算公式为:J=H′/lnS,式中:S为被利用的碳源总数,log选用e为底。
麦金托什指数(U),即McIntosh指数,用来评估基于群落物种多维空间上的欧几里德(Euclidian)距离的多样性,其计算公式为:
另根据Biolog-ECO微孔板内化学基团的性质,生化分类参照Insam[31]的方法,将31种碳源分成六类,分别为多聚物类、碳水化合物、酚类化合物、羧酸类、氨基酸类及胺类。
1.4 数据统计分析本研究数据利用CANOCO 5.0和SPSS软件进行主成分分析(PCA)和聚类分析,以此确定不同地层水中微生物群落结构的相异程度。
2 结果与讨论 2.1 地层水微生物群落颜色平均变化率(AWCD)特征AWCD是衡量地层水微生物群落利用碳源能力的重要指标之一,反映了地层水微生物群落活性和代谢能力。地层水AWCD随着培养时间的延长而增加,在96 h内呈对数递增,随后大部分样品持续缓慢升高直至平稳阶段(图 1)。该趋势与Lee等[22]介绍的石油烃污染地下水微生物群落较为相似,不同样品AWCD变化程度差异较大,最高值达到2左右。L2SHC04在碳源的刺激下,能迅速响应营养源,比报道的水环境样品AWCD值(1~1.6)高[32, 33],表现出较强的代谢活性。但也有地层水微生物群落展现出对碳源利用率低或不利用的情况,如L2SHC024几乎无碳源代谢轮廓,L2SHC06和L2SHC241在开始的24 h内变化不大,说明生长初期微生物群落对碳源利用较低。

|
图 1 颜色平均变化率随培养时间的变化 Figure 1 AWCD changes with incubation time |
不同开发方式地层水微生物群落对碳源代谢AWCD变化趋势为SS>PF>SF。齐108区块SS开发(L2SHC04、L2SHC02及L2SHC06)代谢程度最高,AWCD均值约为1.44。采样井原始地层温度为46 ℃,随着稠油热采开发,油藏内形成高温蒸汽腔,中心温度高达350 ℃,随着热对流、热传导及热辐射等作用,逐渐形成温度梯度场,在宽泛的温度范围内,微生物选择适宜的温度环境生长繁殖,表现出较强的代谢活性和对碳源的利用能力。田燕等[34]也介绍了温度梯度场对微生物群落的影响,研究结果显示辽河稠油藏蒸汽辅助重力泄油(SAGD)开发井在249~259 ℃温度范围内微生物丰富多样。欢2区块PF开发(L2SHC3104)代谢程度次之,单井AWCD值为1.42接近SS开发均值。该井无热采开发过程,但开发历史较为特殊,经历15年水WF开发后于2013年转为PF开发,微生物在长期WF过程中可能形成稳定的群落结构,加入聚合物驱替后,注入水的粘度提高,降低水油流度比,扩大驱油波及体积[35],微生物在油水体系发生较大变异,也表现出较高代谢能力。齐40区块SF开发(L2SHC23、L2SHCH7、L2SHC241及L2SHC024)代谢程度最低,AWCD均值约为0.97,采样井原始地层温度比SS开发低为37℃,蒸汽腔的中心温度范围也比SS开发低为150~290℃,除L2SHC23外,其余井地层水AWCD值都很低(图 1),微生物对碳源利用能力相对较差,且活性较弱,结果表明在热采开发过程中,温度是影响SS和SF开发作用下微生物群落代谢能力的主控因素。
2.2 地层水微生物群落对六类碳源的利用地层水微生物群落对六类碳源的代谢强度存在差异(图 2),对多聚物类和氨基酸类代谢具有明显优势(图 2a和2b),碳水化合物和羧酸类次之(图 2c和2d),对胺类和酚类化合物代谢程度最低(图 2e和2f)。另选取培养120 h时各开发方式中微生物群落对碳源的利用情况进行分析(图 3)。对多聚物类、碳水化合物及胺类代谢程度最高的为齐108区块SS开发(L2SHC04、L2SHC02及L2SHC06)中微生物群落,利用较高的碳源包括多聚物类(吐温40和肝糖),碳水化合物(D-纤维二糖和D-甘露醇)及胺类(苯乙胺)。其中L2SHC04对碳源代谢能力最高,但对酚类化合物(2-羟基苯甲酸)和羧酸类(α-丁酮酸)几乎无利用。L2SHC02对多数碳源的起始利用率低,在96~120 h间幅度突然增大,展现出代谢的独特性。L2SHC06起始阶段对酚类化合物几乎无利用,168 h后AWCD才缓慢增加,说明微生物对酚类化合物代谢程度低且激活迟缓(图 2f)。L2SHC06从培养开始对胺类利用一直处于增长状态,72 h后开始降低直至平稳状态,这可能与微生物生长过程中产生的代谢产物有关,导致部分微生物生长缓慢,代谢活性下降(图 2e)。对酚类化合物、羧酸类及氨基酸类代谢程度最高的为欢2区块PF开发(L2SHC3104)中微生物群落,利用较高的碳源包括酚类化合物(4-羟基苯甲酸),羧酸类(丙酮酸甲酯、α-丁酮酸及D-苹果酸),氨基酸类(L-天冬酰胺酸、L-苯基丙氨酸、L-丝氨酸及L-苏氨酸)(图 3)。齐40区块SF开发(L2SHC23、L2SHCH7、L2SHC241及L2SHC024)整体对碳源代谢能力偏低,仅L2SHC23展现出对六类碳源较好的利用效果,L2SHC024除了对碳水化合物(D-纤维二糖和D-甘露醇)有较弱的作用外,对其余碳源几乎无利用(图 3)。总体而言,根据地层水对碳源的利用情况,展现出各采样井间微生物群落代谢的差异性。

|
图 2 地层水微生物对六类碳源利用的AWCD特征 Figure 2 AWCD characteristics of the utilization of six types of carbon sources by formation water microorganisms 注:(a)多聚物类,(b)氨基酸类,(c)碳水化合物,(d)羧酸类,(e)胺类及(f)酚类化合物;□—□L2SHC02,○—○L2SHC04,△—△L2SHC06,◇—◇L2SHC23,■—■L2SHC024,●—●L2SHC241,◆—◆L2SHCH7,▲—▲L2SHC3104 Note: (a) polymers, (b) amino acids, (c) carbohydrates, (d) carboxylic acids, (e) amines and (f) phenolic compounds; □—□L2SHC02, ○—○L2SHC04, △—△L2SHC06, ◇—◇L2SHC23, ■—■L2SHC024, ●—●L2SHC241, ◆—◆L2SHCH7, ▲—▲L2SHC3104 |

|
图 3 地层水微生物对31种碳源利用的特征热图(120 h) Figure 3 Characteristics heatmap of the utilization of 31 carbon sources by formation water microorganisms at 120 h 注:从红色到蓝色表示数值逐渐降低 Note:the value decreases gradually from red to blue |
通过H′值、D值、J值及U值等指数从不同侧面反映微生物群落功能多样性。研究结果显示H′值、D值及J值在0~24 h都表现出不稳定状态,说明培养初期先进入选择与适应阶段,多样性呈现起伏状态,48 h后各指数逐渐提升(图 4)。培养120 h时各开发方式中微生物群落H′值、J值及U值趋势为PF>SS>SF,这与万云洋等[14]利用PCR-DGGE研究不同开发方式作用下微生物群落多样性趋势一致。欢2区块PF开发(L2SHC3104)和齐108区块SS开发(L2SHC04、L2SHC02及L2SHC06)中H′值、J值及U值较高且十分接近,如H′值分别约为3.16和3.15,比用高通量测序检测SAGD开发地层水的H′值3.50偏低[34],但也处于多样化程度较高水平,J值分别约为0.96和0.95,这些指数展现出微生物群落较高的多样性和均匀度(图 4)。虽然齐40区块SF开发(L2SHC23、L2SHCH7、L2SHC241及L2SHC024)中L2SHC23的H′值和D值分别接近和超过代谢水平最高的L2SHC04,但SF开发整体多样性和均匀度水平偏低(图 4a和4b)。D值趋势为SS>PF>SF,前两种开发方式均值也十分接近,分别为0.93和0.92。与AWCD变化相比,阐明地层水微生物群落在SS开发中活性最高,在PF开发中丰富度、多样性及均匀度最高,说明L2SHC3104独特的开发历史给稠油藏地层水微生物群落的多样化带来很大影响。

|
图 4 地层水微生物群落功能多样性 Figure 4 Functional diversity of microbial communities from formation water |
为了进一步了解各开发方式作用下微生物群落对碳源利用能力的差异,对培养120 h时的碳源进行PCA分析,通过线性变换,将对31个碳源的利用情况转化为少数几个主要成分,并尽可能多地保留原始变量的信息,方差最大的为第1主成分,依次按照方差贡献率大小排列,结果显示7个主成分累积方差贡献率达100%,第1个主成分(PC1)为57.81%,第2个主成分(PC2)为17.25%,第3~7主成分贡献率较小,仅占0.78%~8.66%。PC1和PC2是变异的主要来源,可以解释变量的绝大部分信息(表 2,图 5a和5b)。
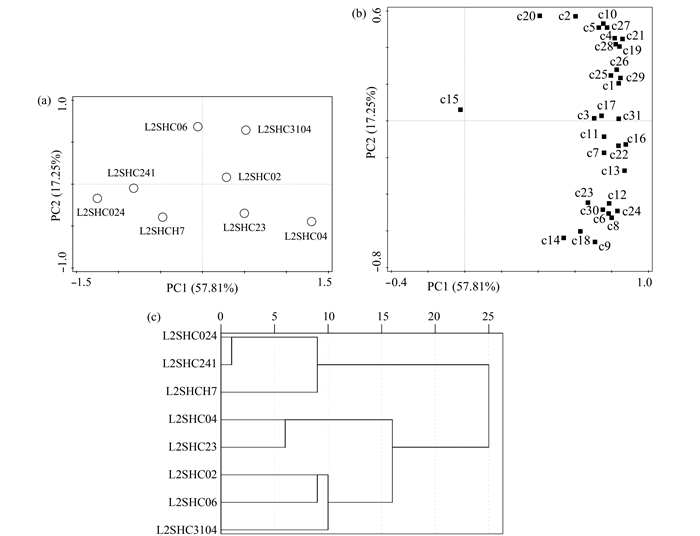
|
图 5 地层水微生物对碳源代谢主成分分析 Figure 5 Principal component analysis of carbon source utilization of formation water microorganisms 注:(a)为地层水样品的分布情况;(b)微生物对31种碳源利用的分布情况(120 h);○表示采样井,■表示碳源,图中仅显示碳源编号,具体碳源参照表 2;(c)系统聚类图,聚类方法为组间连接,计算区间为平方Euclidean距离 Note:(a)the distribution of formation water samples; (b)the distribution of the utilization of 31 carbon sources by microorganisms at 120 h; ○ indicates sampling wells, ■ indicates carbon source, which are only shown in the form of No. in the figure, and the specific carbon sources reference table 2; (c)hierarchical clustering, clustering method for the connection between groups, calculate the interval for square Euclidean distance |
|
|
表 2 31种碳源在第1、2主成分上的因子载荷矩阵 Table 2 Component matrix of 31 carbon sources loaded on the first and second principal components |
因子载荷矩阵是各原始变量因子表达式的系数,表达提取的公因子对原始变量的影响程度。主成分与碳源利用的相关性可通过初始因子载荷情况来反映,因子载荷越高,表明该碳源对主成分影响越大[36]。分析表明与PC1相关性较高的碳源共有29种(因子载荷的绝对值>0.50)[37],除酚类化合物(2-羟基苯甲酸)和羧酸类(α-丁酮酸)外(表 2和图 5b)。与PC2相关性的较高碳源共有10种(因子载荷的绝对值>0.50),包括多聚物(吐温80),碳水化合物(D-纤维二糖、α-D-乳糖、I-赤藓糖醇及D-甘露醇),羧酸类(r-羟基丁酸和α-丁酮酸),氨基酸类(L-丝氨酸和D-半乳糖酸γ-内酯)及胺类(苯乙胺)(表 2和图 5b)。纵观微生物群落对六类碳源的利用和PCA分析可知代谢优势顺序为多聚物>氨基酸类>碳水化合物>羧酸类>酚类化合物>胺类(表 2,图 2),主要受SS和PF开发影响。
主成分分析中样方间距表示采样井间相似程度,距离越近表明相似性越高,结果显示SF开发中L2SHC024与L2SHC241和L2SHCH7距离最近(图 5a),但与其余采样井相距较远。SS开发的L2SHC04和SF开发的L2SHC23距离最近(图 5a),两口采样井虽然不属于同一种开发方式,但两者在各自区块内微生物代谢活性和多样性均最高,且具有相似的代谢特征。SF开发的L2SHC02和L2SHC06与PF开发的L2SHC3104距离最近(图 5a),表明也有相似的代谢特征。另外,通过聚类分析也验证了采样井间的分布和间距(图 5c)。
3 结论根据碳源动力学特征分析,不同开发方式地层水微生物群落对碳源代谢活性趋势为SS>PF>SF,六类碳源中对多聚物类和氨基酸类代谢具有明显优势,碳水化合物和羧酸类次之,对胺类和酚类化合物代谢程度最低。其中微生物群落对多聚物、碳水化合物及胺类代谢程度最高的来自SS开发,对酚类、羧酸类及氨基酸类代谢程度最高的来自PF开发。多样性指数结果显示整体趋势为PF>SS>SF,呈现出代谢功能的多样化。主成分分析显示PC1和PC2是变异的主要来源,可以解释变量的绝大部分信息,与PC1相关性较高的碳源共有29种,与PC2相关性的较高碳源共有10种,说明地层水微生物群落对多数碳源均可利用。综上所述,稠油藏不同开发方式中热采引起的温度梯度场效应和驱替历史为代谢功能多样性的主控因素,地层水微生物群落在SS开发作用下活性最高,在PF开发作用下丰富度、多样性及均匀度最高,但都呈现较高的代谢功能多样性,间接证明油藏内涵盖丰富的微生物资源。
| [1] |
Zhu G Y, Zhang S C, Huang H P, et al. Induced H2S formation during steam injection recovery process of heavy oil from the Liaohe Basin, NE China[J]. J Petrol Sci Eng, 2010, 71(1-2): 30-36. DOI:10.1016/j.petrol.2010.01.002 |
| [2] |
Gong Y J, Wang Z Y, Zhao C M, et al. Convert to steam flooding after cyclic steam stimulation in Block Qi40[J]. Special Oil and Gas Reservoirs, 2007, 14(6): 17-21. 龚姚进, 王中元, 赵春梅, 等. 齐40块蒸汽吞吐后转蒸汽驱开发研究[J]. 特种油气藏, 2007, 14(6): 17-21. |
| [3] |
Wang Z Y. Study on steam sweep in Block Qi40 steam drive process[J]. Special Oil and Gas Reservoirs, 2007, 14(4): 65-67. 王中元. 齐40块蒸汽驱蒸汽波及规律研究[J]. 特种油气藏, 2007, 14(4): 65-67. |
| [4] |
Zhang F L, Zhao H Y. Development technology of heavy oil injection steam in Liaohe Oilfield[M]. Beijing: Petroleum Industry Press, 2007, 104-105. 张方礼, 赵洪岩. 辽河油田稠油注蒸汽开发技术[M]. 北京: 石油工业出版社, 2007, 104-105. |
| [5] |
Tian Y, Wan Y Y, Zhang Y Y, et al. The mechanism investigation of endogenous hydrogen sulfide in low-sulfur heavy oil reservoirs by biomass pyrolysis[C]// Abstract Collections of 29th Chinese Chemical Society Congress. Beijing, 2014: 105. 田燕, 万云洋, 张妍妍, 等. 低硫稠油藏硫化氢成因机理的生物质热劈研究[C]//中国化学会第29届学术年会摘要集. 北京, 2014: 105. |
| [6] |
Wan Y Y, Mu H M, Tian Y, et al. Sulfur circulating microbial communities and the hydrogen sulfide blooming in the exploitation of Liaohe Heavy Oil Reservoirs, China[C]// Abstract Collections of 16th International Symposium on Microbial Ecology. Montreal: Organizer, 2016: 521.
|
| [7] |
Wan Y Y, Hong N, Gu X Y, et al. Characteristics of internally corrosion-induced microbiota of the petroleum pipelines in Liaohe Oilfield[C]// Abstract Collections of 6th National Conference of Microbial Resources & the International Symposium on Microbial Systematics and Taxonomy. Xiamen, 2014: 105. 万云洋, 洪宁, 顾雪莹, 等. 辽河油田油气管道内腐蚀性微生物菌群组成[C]//第六届全国微生物资源学术暨国家微生物资源平台运行服务研讨会摘要集. 厦门, 2014: 105. |
| [8] |
Javaherdashti R. A review of some characteristics of MIC caused by sulfate-reducing bacteria: past, present and future[J]. Anti-Corros Method M, 1999, 46(3): 173-180. DOI:10.1108/00035599910273142 |
| [9] |
Li X X, Liu J F, Zhou L, et al. Diversity and composition of sulfate-reducing microbial communities based on genomic DNA and RNA transcription in production water of high temperature and corrosive oil reservoir[J]. Front Microbiol, 2017, 8: 1011. DOI:10.3389/fmicb.2017.01011 |
| [10] |
Du W D, Wan Y Y, Zhong N N, et al. Status quo of soil petroleum contamination and evolution of bioremediation[J]. Petroleum Science, 2011, 8(4): 502-514. DOI:10.1007/s12182-011-0168-3 |
| [11] |
Smith C J, Mckew B A, Coggan A, et al. Primers: Functional genes for nitrogen-cycling microbes in oil reservoirs. In: McGenity T, Timmis K, Nogales B. (eds) Hydrocarbon and lipid microbiology protocols. Springer protocols handbooks[M]. Berlin: Springer, 2016, 207-241.
|
| [12] |
Vigneron A, Alsop E B, Lomans B P, et al. Succession in the petroleum reservoir microbiome through an oil field production lifecycle[J]. ISME J, 2017, 11(9): 2 141-2 154. DOI:10.1038/ismej.2017.78 |
| [13] |
Cai M, Nie Y, Chi C Q, et al. Crude oil as a microbial seed bank with unexpected functional potentials[J]. Sci Rep, 2015, 5(1): 16 057. DOI:10.1038/srep16057 |
| [14] |
Wan Y Y, Mu H M, Hong N, et al. Microbial diversity in heavy oil reservoirs analyzed by PCR-DGGE[C]// Abstract Collections of 29th Chinese Chemical Society Congress. Beijing, 2014: 105. 万云洋, 穆红梅, 洪宁, 等. 聚合酶链反应-变性梯度凝胶电泳研究稠油藏微生物多样性[C]//中国化学会第29届学术年会摘要集. 北京, 2014: 105. |
| [15] |
Wan Y Y, Mu H M, Tan Y, et al. Microbial communities of heavy oil reservoirs with anthropogenic activities[C]// Abstract Collections of 6th National Conference of Microbial Resources & the International Symposium on Microbial Systematics and Taxonomy. Xiamen, 2014: 30. 万云洋, 穆红梅, 田燕, 等. 人工干预稠油藏微生物群落研究[C]//第六届全国微生物资源学术暨国家微生物资源平台运行服务研讨会摘要集. 厦门, 2014: 30. |
| [16] |
Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Appl Environ Microb, 1991, 57(8): 2 351-2 359. |
| [17] |
Jiang L L, Han G M, Lan Y, et al. Corn cob biochar increases soil culturable bacterial abundance without enhancing their capacities in utilizing carbon sources in Biolog Eco-plates[J]. J Integr Agr, 2017, 16(3): 713-724. DOI:10.1016/S2095-3119(16)61338-2 |
| [18] |
Feigl V, Ujaczki É, Vaszita E, et al. Influence of red mud on soil microbial communities: application and comprehensive evaluation of the Biolog EcoPlate approach as a tool in soil microbiological studies[J]. Sci Total Environ, 2017, 595: 903-911. DOI:10.1016/j.scitotenv.2017.03.266 |
| [19] |
Rutgers M, Wouterse M, Drost S M, et al. Monitoring soil bacteria with community-level physiological profiles using BiologTM ECO-plates in the Netherlands and Europe[J]. Appl Soil Ecol, 2016, 97: 23-35. DOI:10.1016/j.apsoil.2015.06.007 |
| [20] |
Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. J microbiol Meth, 1999, 36(3): 203-213. DOI:10.1016/S0167-7012(99)00034-2 |
| [21] |
Fliermans C B, Franck M M, Hazen T C, et al. Ecofunctional enzymes of microbial communities in ground water[J]. FEMS Microbiol Rev, 1997, 20(3-4): 379-389. DOI:10.1111/j.1574-6976.1997.tb00323.x |
| [22] |
Lee E H, Kim J, Kim J Y, et al. Comparison of microbial communities in petroleum-contaminated groun-dwater using genetic and metabolic profiles at Kyonggi-Do, South Korea[J]. Environ Earth Sci, 2010, 60(2): 371-382. DOI:10.1007/s12665-009-0181-7 |
| [23] |
Gao X Q, Xiao N W, Ye Y, et al. Analysis of microbial community functional diversity in the Changqing Oilfield based on Biology-ECO method[J]. Chinese Journal of Applied & Environmental Biology, 2014, 20(5): 913-918. 高晓奇, 肖能文, 叶瑶, 等. 基于Biolog-ECO分析长庆油田土壤微生物群落功能多样性特征[J]. 应用与环境生物学报, 2014, 20(5): 913-918. |
| [24] |
Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles—a critique[J]. FEMS Microbiol Ecol, 2002, 42(1): 1-14. |
| [25] |
Smalla K, Wachtendorf U, Heuer H, et al. Analysis of BIOLOG GN substrate utilization patterns by microbial communities[J]. Appl Environ Microb, 1998, 64(4): 1 220-1 225. |
| [26] |
Wan Y Y, Dong H L. Environment geomicrobiology experiments[M]. Beijing: Petroleum Industry Press, 2014, 188-190. 万云洋, 董海良. 环境地质微生物学实验指导[M]. 北京: 石油工业出版社, 2014, 188-190. |
| [27] |
Shannon C E. A mathematical theory of communication[J]. Bell Labs Tech J, 1948, 27(4): 623-656. DOI:10.1002/bltj.1948.27.issue-4 |
| [28] |
Magurran A E. Measuring biological diversity[M]. Malden: Blackwell, 2004, 106-116.
|
| [29] |
Simpson E H. Measurement of diversity[J]. Nature, 1949, 163: 688. DOI:10.1038/163688a0 |
| [30] |
Pielou E C. Mathematical ecology[M]. New York: John Wiley & Sons, 1977, 364-375.
|
| [31] |
Insam H. A new set of substrates proposed for community characterization in environmental samples[M]. Berlin: Springer, 1997, 259-260.
|
| [32] |
Jalowiecki Ł, Chojniak J M, Dorgeloh E, et al. Microbial community profiles in wastewaters from onsite wastewater treatment systems technology[J]. PLoS One, 2016, 11(1): e147725. |
| [33] |
Deng H H, Ge L Y, Xu T, et al. Analysis of the metabolic utilization of carbon sources and potential functional diversity of the bacterial community in lab-scale horizontal subsurface-flow constructed wetlands[J]. J Environ Qual, 2011, 40(6): 1 730-1 736. DOI:10.2134/jeq2010.0322 |
| [34] |
Tian Y, Wan Y Y, Mu H M, et al. Differences of microbial in genus level of two high temperature heavy oil wells from same block with a history of 10 years SAGD history[C]// Proceedings of 2006 Annual Meeting of Chinese Geoscience Union. Beijing: China electronic audio and video publishing house, 2016: 61. 田燕, 万云洋, 穆红梅, 等. 高温、同一区块具有10年SAGD开采历史的两口稠油井中在菌属水平上的微生物的差异性[C]//2016年北京地球科学联合会议会议集. 北京: 中国电子音像出版社, 2016: 61. |
| [35] |
Romero-Zerón L. Chemical enhanced oil recovery (cEOR)—a practical overview[M]. Croatia: InTech, 2016, 55-99.
|
| [36] |
Shi P, Gao Q, Wang S P, et al. Effects of continuous cropping of corn and fertilization on soil microbial community functional diversity[J]. Acta Ecologica Sinica, 2010, 30(22): 6 173-6 182. 时鹏, 高强, 王淑平, 等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报, 2010, 30(22): 6 173-6 182. |
| [37] |
Zhu Y H, Tan H X, Sun D C, et al. Analysis of carbon metabolism diversity characters of moving bed biofilm reactor at different biodegradation process in recirculating aquaculture systems using Biolog-ECO method[J]. Journal of Shanghai Ocean University, 2017, 26(1): 64-74. 朱云昊, 谭洪新, 孙大川, 等. Biolog-ECO解析循环水鳗鲡养殖系统中不同生物降解工艺下的滤料微生物群落功能多样性特征[J]. 上海海洋大学学报, 2017, 26(1): 64-74. DOI:10.12024/jsou.20160401729 |
 2018, Vol. 40
2018, Vol. 40


