内生菌(endophyte)是指那些生活史的部分或全部阶段生活于健康植物的各种组织和器官内部的微生物。研究发现,不仅从种类繁多的植物中可以分离得到内生菌,而且在同一种植物的根、茎、叶、花、果实和种子等中均有内生菌被发现[1]。内生菌数量庞大,种类众多,包括内生真菌、内生细菌和内生放线菌等[2]。植物内生菌具有丰富的生物多样性,对于同一种植物,从中可分离到的内生真菌或细菌通常有几种至几十种,有的甚至可达几百种[3]。
对内生菌多样性的研究,传统方法主要是应用微生物培养技术,从特定的样品中通过分离、培养等获得微生物的纯培养物,再进行菌株的分类鉴定[4]。近些年来,研究者们尝试不进行分离培养而直接提取环境样本的所有DNA,即宏基因组。通过对宏基因组进行测序,理论上能够获得该样本中所有微生物的DNA序列信息[5],可以对样品进行较客观的分析,较精确地揭示微生物种类的多样性。
沙棘为胡颓子科(Elaeagnaceae)沙棘属(Hippophae)植物,在甘南地区生长的沙棘主要有西藏沙棘(Hippophae thibetana)和中国沙棘(Hippophae rhamnoides)。西藏沙棘生长于高海拔(3 000~5 300 m)的高原草地河漫滩及岸边,属于喜光、耐寒,适合于高寒地区生长的灌丛型植物[6]。沙棘根系发达,根际区系的微生物类群非常丰富[7],沙棘属植物能够在根部形成根瘤固氮。与沙棘形成根瘤共生固氮的主要是弗兰克氏菌(Frankia)。弗兰克氏菌又称为根瘤内生菌,是一种放线菌。有关沙棘内生菌的研究,多集中在弗兰克氏菌的研究方面[8]。对于沙棘属植物非弗兰克氏菌内生菌的研究,已有学者以生长在毛乌素沙漠的野生沙棘,用其根、茎、叶的健康组织为材料分离到内生菌[9],其他研究还鲜见报道。
目前研究发现,各植物体中存在的内生菌的数量、种类与植物的种类、生存环境、生长阶段、营养供给及两者的基因型有密切关系[10, 11]。不同地区、不同环境下生长的同一种植物组织中存在的内生菌种类和数目均有较大的差异,即使同一地区的同一植物不同组织部位中内生菌的数量和种类也不相同。因此,我们采用基于免培养的高通量测序技术,对甘南高寒地区不同海拔的西藏沙棘内生菌多样性进行研究和探讨,以期了解同一地区、不同海拔下生长的西藏沙棘根瘤中存在的内生菌种类和数目的差异,为揭示沙棘属植物与内生菌相互作用的研究奠定理论基础。
1 材料和方法 1.1 采样地概况于2015年8月采集甘南合作市西藏沙棘根瘤样品。每个样地各选择5株沙棘植株,采样时除去表土,挖取沙棘主根及侧根,得到长有新鲜根瘤的沙棘瘤块,去除瘤块表面的疏松土壤,将根瘤样品装入无菌袋中并编号,记录采样时间、地点、环境条件等。样品带回实验室后,-20 ℃保存备用。甘南地区3个不同海拔的样地分别编号A、B和C,各样地的具体信息见表 1。
|
|
表 1 甘南地区西藏沙棘样地基本信息 Table 1 Basic information of the Hippophae thibetana samples in Gannan area |
采用改良的CTAB法提取沙棘根瘤总DNA。选取新鲜幼嫩的沙棘根瘤尖端含菌组织,用75%乙醇和1%NaClO溶液对沙棘根瘤样品表面消毒,在CTAB提取缓冲液中加入β-巯基乙醇并适当延长水浴时间。对所提沙棘根瘤内生菌总DNA的浓度、纯度和完整性进行检测。
1.3 16S rDNA序列扩增和MiSeq测序将各样品总DNA作为模板DNA,通过细菌16S rDNA-V4区引物扩增各样品,所用引物为:515F(5′-GTGCCAGCMGCCGCGG-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′),由Illumina MiSeq测序仪进行测序。样品的扩增及测序工作由上海派森诺生物科技有限公司完成。
1.4 高通量测序数据分析采用Mothur, MEGAN, Qiime和STAMP等软件,对微生物群落高通量测序数据进行分析。
2 结果与分析 2.1 西藏沙棘根瘤内生细菌OTU分析在微生物生态学领域,OTU(可操作分类单元, operational taxonomic unit)通常是指根据某一人为设定的序列相似度阈值,将来自一个或多个样本的序列进行归并,彼此间相似度高于该阈值的序列都将归并为一个OTU,以此对不同来源的微生物群落样本进行互相比较[5]。
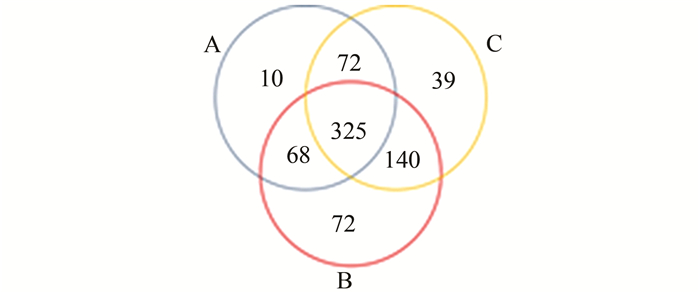
Venn图结果可以展示三种不同海拔样品包含的共有和各自特有OTU数目,展示样品间OTU的重叠情况。结合OTU所代表的物种,可以找出不同海拔样品中的微生物种数。如图 1所示,A样地中含有细菌种类475个,B样地中605个,C样地中含有576个。其中,A和B有相同种类393个,即36.4%的种类是相同的。A与C共有397个,共有种类约37.8%;B和C共有465个,共有种类约39.4%。A、B和C共有OTU 325个,即19.6%的种类同时出现在3个不同海拔样品中。
|
图 1 3个不同海拔根瘤内生细菌的OTU维恩图 Figure 1 OTU Venn diagram of nodule endophytic bacteria at three altitudes |
由于高通量测序建库过程中的PCR扩增会产生嵌合体序列,测序过程中会产生点突变等测序错误,为了保证分析结果的准确性,需要对有效序列进行进一步过滤和去除嵌合体处理,得到最终用于后续分析的优质序列。通常在97%的相似水平下对序列进行OTU的聚类和后续的生物信息分析。本次测序各样品的序列数统计表见表 2。
|
|
表 2 3个不同海拔西藏沙棘根瘤内生细菌序列数 Table 2 Sequence number of endophytic bacteria of Hippophae thibetana nodule at three altitudes |
通过对细菌16S rDNA的可变区进行测序,在97%的相似度下,对所有序列进行OTU划分,然后计算菌群多样性。几个物种Alpha多样性指数,可以反映各群落内微生物多样性的丰富度。细菌群落丰度指数Chao1或ACE越大,表明群落的物种数越多,Shannon指数值越高,表明群落的多样性越高,Simpson指数值越高,表明群落的多样性越低。一般而言,Shannon指数对群落的丰富度以及稀有OTU更敏感,而Simpson指数对均匀度和群落中的优势OTU更敏感[9]。
各处理的微生物丰富度和多样性指数见表 3。从表中可以看出,在3个不同海拔样品中,Chao1指数、ACE指数、Shannon指数和Simpson指数值均在样品B中表现为最大,在样品A中最小。可见,在海拔3 251 m时,西藏沙棘根瘤内生细菌群落的物种数最多,多样性最为丰富;而在海拔3 027 m时,西藏沙棘根瘤内生细菌群落的物种数最少,多样性也最低。
|
|
表 3 3个不同海拔西藏沙棘根瘤内生细菌群落多样性指数 Table 3 Diversity index of nodule endophytic bacteria of Hippophae thibetana at three altitudes |
采用高通量测序技术,研究3个不同海拔下,西藏沙棘根瘤内生细菌的群落结构随海拔及其生境的变化规律[10]。从门水平分析,3种不同海拔生境的样地中共包含6个门类的细菌。由图 2中可以看出,占主导地位的微生物是蓝藻门(Cyanobacteria)和放线菌门(Actinobacteria),变形菌门(Proteobacteria)也有一定数量的分布。蓝藻门在样地A、B和C中分别占68.1%,64.7%和66.0%;放线菌门在样地A、B和C中分别占28.6%,30.2%和29.5%;变形菌门在样地A、B和C中分别占1.3%,3.5%和2.3%;可见,放线菌门和变形菌门微生物数量在样地海拔3 251 m最多,而蓝藻门微生物数量却在此海拔高度时相对最少。拟杆菌门(Bacteroidetes)在样地A、B和C中均占0.2%,梭杆菌门(Fusobacteria)和厚壁菌门(Firmicutes)在样地A、B和C中均占0.1%,在样地A、B和C中未注释出的门分别占到1.6%,1.6%和1.1%。

|
图 2 3个不同海拔西藏沙棘根瘤内生细菌门水平相对丰度 Figure 2 Relative abundance of nodule endophytic bacterium phyla at three altitudes |
从纲水平分析,3种不同海拔生境的样地中共包含7大纲类的细菌。其中,变形菌门包含3个纲,γ变形菌纲(Gammaproteobacteria)在样地A、B和C中分别占0.4%,1.6%和1.2%,变形菌纲A亚群(Alphaproteobacteria)在样地A、B和C中分别占0.6%,1.2%和0.8%,变形菌纲B亚群(Betaproteobacteria)在样地A、B和C中分别占0.3%,0.7%和0.4%。其他门均包含1个纲,放线菌门只包含1个纲放线菌纲(Actinobacteria);拟杆菌门只包含1个纲拟杆菌纲(Bacteroidia);梭杆菌门只包含1个纲梭杆菌纲(Fusobacteriia);厚壁菌门只包含1个纲梭菌纲(Clostridia);蓝藻门的内生菌未归类到纲。
从目水平分析,放线菌纲只包含1个目放线菌目(Actinomycetales);变形菌纲(Gammaproteobac-teria)只包含1个目假单胞菌目(Pseudomonadales);变形菌纲A亚群包含2个目,立克次氏体目(Rickettsiales)和根瘤菌目(Rhizobiales);变形菌纲B亚群只包含1个目伯克氏菌目(Burkholderiales);其他纲分别都只包含1个目。
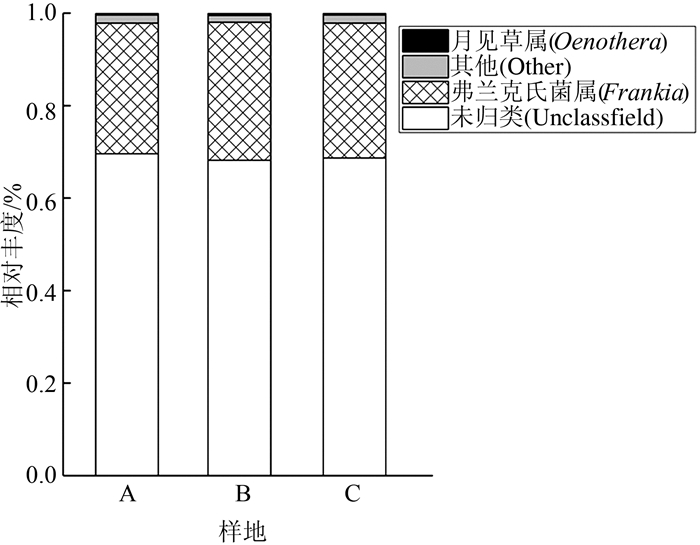
以属水平分析,从图 3中可以看出,3种不同海拔生境的样地中根瘤内生菌未归类到属的微生物在样地A、B和C中分别占69.6%,68.2%和68.7%。在未归类到属的微生物中占主导地位的微生物是蓝藻门, 在样地A、B和C中分别占到68.1%,64.7%和66.0%,在3个样地平均含量达到了66.3%;由于此类蓝藻门内生菌未能注释到属水平,所以图 3中我们将其标记为unclassified属。而放线菌目(Actinomycetales)弗兰克氏菌科(Frankiaceae)的弗兰克氏菌属(Frankia)在样地A、B和C中分别占28.2%,29.8%和29.1%,弗兰克氏菌属(Frankia)为样地A、B和C的共有属。弗兰克氏菌科其他属在样地A、B和C中各占了0.1%。链霉菌科(Streptomycetaceae)链霉菌属(Streptomyces)在样地A、B和C中各占了0.1%。Mitochondria科月见草属(Oenothera)在样地A、B和C中分别占0.4%,0.5%和0.4%。类固醇杆菌属(Steroidobacter)为样地A特有属;詹森菌属(Janthinobacterium),叶杆菌属(Phyllobacterium),拉恩菌属(Rahnella),变形菌纲(Gammaproteobacteria),草酸杆菌科(Oxalobacteraceae)为样地B特有物种;节细菌属(Arthrobacter)为样地C特有属,且各特有属种在各样地中所占比例较小,均为0.1%。
|
图 3 3个不同海拔西藏沙棘根瘤内生细菌属水平相对丰度 Figure 3 Relative abundance of nodule endophytic bacterium genera at three altitudes |
物种丰度差异性分析结果表明(见表 4),3个样地之间微生物多样性差异从门水平来看,不存在差异。从属水平来看,样地A和B之间有8个不同的属;样地B和C之间有6个不同的属;样地A和C之间有1个不同的属。
|
|
表 4 物种丰度差异性分析统计表 Table 4 Statistical analysis table of species richness between different groups |
本研究从甘南高寒地区3个不同海拔的西藏沙棘根瘤瘤块中提取总DNA后,进行高通量测序。测序结果表明3个海拔的西藏沙棘根瘤瘤块中的内生菌中,除了能与沙棘共生固氮的弗兰克氏菌属外,还存在其他种类的内生菌,这与李琦对野生沙棘根部内生菌的多样性的研究结果相似[9]。
研究发现,西藏沙棘根瘤内生细菌群落组成中的优势细菌门均为蓝藻门和放线菌门,并且在3个不同海拔生长的西藏沙棘根瘤中的蓝藻门细菌含量均达到了64.7%以上,含量占到沙棘根瘤内生菌总量的一半以上,在海拔3 027 m时,蓝藻门在根瘤中的含量最高,为68.1%。但蓝藻门的内生菌测序时未能注释到属,后续应该继续对其进行研究分析,以进一步阐明其在不同海拔西藏沙棘根瘤内的多样性。由于蓝藻门细菌分布极广,并且在极端环境中也能生长,还能与一些植物共生[12]。而蓝藻门细菌在沙棘根瘤中的存在状况以及与沙棘之间的关系还有待进一步研究。
在西藏沙棘根瘤中存在的放线菌门微生物主要是弗兰克氏菌。弗兰克氏菌也是含量较高的内生菌,本研究也发现,在3个不同海拔生长的西藏沙棘根瘤中的弗兰克氏菌含量均达到了28.2%以上;生长在海拔3 251 m的西藏沙棘,根瘤中弗兰克氏菌的含量最高,为29.8%。由于弗兰克氏菌能与沙棘共生固氮,形成根瘤,所以很多学者在研究沙棘根瘤时,主要针对与其共生的弗兰克氏菌,侧重研究根瘤中弗兰克氏菌的形态、生理生化特性以及其种类等[13]。弗兰克氏菌在属以下的分类在本次研究中也未被细分,因此,还需要对研究结果进行进一步深入,挖掘相关的功能基因,了解不同海拔西藏沙棘根瘤中的弗兰克氏菌的差异,探索西藏沙棘根瘤内生菌的群落结构与沙棘生长海拔生境的关系,以探明不同海拔生长的沙棘根瘤弗兰克氏菌种类之间有无差异,以及沙棘中存在的弗兰克氏菌的丰度变化会对沙棘的生长造成怎样的影响。
在西藏沙棘根瘤中存在的微生物还包括变形菌门,拟杆菌门,梭杆菌门和厚壁菌门,它们在3个样地中的含量均在0.1%~3.5%范围之内,明显少于蓝藻门和放线菌门。在样地A、B和C中未鉴定出的门分别占1.6%,1.6%和1.1%。可见,非豆科植物西藏沙棘根瘤内存在除根瘤菌外的非结瘤内生菌,并且表现出了丰富的多样性,这些内生菌的入侵,对西藏沙棘生长的影响和对它们的促生机制的研究也有待进一步深入。在沙棘根瘤中发现的这些非根瘤菌的细菌类群,回接原宿主植物能不能有效结瘤,也是值得进一步研究的问题。
| [1] |
Hao X J. Endophytic bacteria[M]. Beijing: China Agricultural Science and Technology Press, 2010, 1-40. 郝晓娟. 植物内生菌[M]. 北京: 中国农业科学技术出版社, 2010, 1-40. |
| [2] |
Santoyo G, Moreno-Hagelsieb G, Orozco-Mosqueda M D C, et al. Plant growth-promoting bacterial endophytes[J]. Microbiol Res, 2016, 183: 92-99. DOI:10.1016/j.micres.2015.11.008 |
| [3] |
Wang Z W, Ji Y L, Chen Y G. Studies and biological signficances of plant endophytes[J]. Microbiology, 2015, 42(2): 349-363. 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. |
| [4] |
Wen C Y, Wu Y H, Tian X L. Recent anvances and issues on the endophyte[J]. Chinese Journal of Ecology, 2004, 23(2): 86-91. 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志, 2004, 23(2): 86-91. |
| [5] |
Fykse E M, Aarskaug T, Madslien E H, et al. Microbial community structure in a full-scale anaerobic treatment plant during start-up and first year of operation revealed by high-throughput 16S rRNA gene amplicon sequencing[J]. Bioresour Technol, 2016, 222: 380-387. DOI:10.1016/j.biortech.2016.09.118 |
| [6] |
Chen X L, Ma R J, Sun K. Germplasm resource and habitat types of Seabuckthom in China[J]. Acta Botanica Boreall-Occidentalla Sinica, 2003, 23(3): 451-455. 陈学林, 马瑞君, 孙坤, 等. 中国沙棘属种质资源及其生境类型的研究[J]. 西北植物学报, 2003, 23(3): 451-455. |
| [7] |
Zhang A M, Niu S Q, Da W Y, et al. Identification of an actinomyces producing green pigment and detection of pigment stability[J]. Journal of Northwest Normal University (Natural Science), 2010, 46(3): 89-93. 张爱梅, 牛世全, 达文燕, 等. 一株产绿色素放线菌的初步鉴定及其色素稳定性的检测[J]. 西北师范大学学报:自然科学版, 2010, 46(3): 89-93. |
| [8] |
Zhang A M, Niu S Q, Sun K, et al. Hippophae and Frankia isolation[J]. Grassland and Turf, 2010, 30(2): 43-46. 张爱梅, 牛世全, 孙坤, 等. 沙棘属植物结瘤特性及Frankia根瘤菌分离[J]. 草原与草坪, 2010, 30(2): 43-46. |
| [9] |
Li Q, Sun G Y. Isolation and identification of endophytea from Hippophae[J]. Chinese Agricultural Science Bulletin, 2006, 22(10): 300-302. 李琦, 孙广宇. 沙棘内生菌的分离与初步鉴定[J]. 中国农学通报, 2006, 22(10): 300-302. DOI:10.3969/j.issn.1000-6850.2006.10.072 |
| [10] |
Huang J Y, Zhang C J, Yao Y L, et al. Progress in antimicrobial substance of endophytes[J]. Chinese Journal of Biotechnology, 2017, 33(2): 178-186. 黄敬瑜, 张楚军, 姚瑜龙, 等. 植物内生菌抗菌活性物质研究进展[J]. 生物工程学报, 2017, 33(2): 178-186. |
| [11] |
Sun J Q, Guo L D, Zang W, et al. Ecological distribution and diversity of endophytic fungi in medicinal plants[J]. Science China serices C, 2008, 38(5): 475-484. 孙剑秋, 郭良栋, 臧威, 等. 药用植物内生真菌多样性及生态分布[J]. 中国科学: C辑, 2008, 38(5): 475-484. |
| [12] |
Wang Y Z, Pan Y G, He Y Q. Study and utilization on symbiotic relation between microbes and plants[J]. Chinese Journal of Eco-Agriculture, 2003, 11(3): 95-98. 王元贞, 潘廷国, 柯玉琴. 微生物与植物共生关系的研究及其利用[J]. 中国生态农业学报, 2003, 11(3): 95-98. |
| [13] |
Chen L H, Yu X M, Yao G M, et al. Genetic diversity of Frankia in nodules of Hippophae rhamnoides ssp. sinensis[J]. Acta ecologica sinica, 2008, 28(9): 4213-4220. 陈立红, 于学梅, 姚贵敏, 等. 中国沙棘(Hippophae rhamnoides ssp. Sinensis)根瘤内Frankia菌的遗传多样性[J]. 生态学报, 2008, 28(9): 4213-4220. |
 2018, Vol. 40
2018, Vol. 40

